
12.下列能确认化学平衡一定发生移动的是( )
A.化学反应速率发生改变
B.有气体参加的可逆反应达到平衡后,改变体系压强
C.由于某一条件的改变,使平衡混合物中各组分的物质的量浓度发生改变
D.没有气体参加的可逆反应达到平衡后,改变体系的温度
11.在恒容容器中,对于反应:2SO2(g)+O2(g) 2SO3(g),SO2和O2起始时分别为20mol和10mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
2SO3(g),SO2和O2起始时分别为20mol和10mol;达平衡时,SO2的转化率为80%。若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起始时SO3的物质的量及其转化率为( )
A.10 mol和10% B.20 mol和20% C.20 mol和40% D.20 mol和80%
10.对反应:X(g) +3Y(g) 2Z (g),下列反应速率中最快的是 ( )
2Z (g),下列反应速率中最快的是 ( )
A.v(X)=0.3 mol·L-1·min-1 B.v(Y)=0.6 mol·L-1·min-1
C.v(Z)= 0.5mol·L-1·min-1 D.v(X)=0.01 mol·L-1·s-1
9. 钨酸盐在新材料的制造中有重要应用,一种钨酸盐的制备方式如下:
2GeO (g)+W2O6(g) 2GeWO4(g) △H<0。下列说法中正确的是( )
2GeWO4(g) △H<0。下列说法中正确的是( )
A.增大压强可提高GeWO4的产率
B.增加GeO有利于提高GeO的转化率
C.实际生产中为提高经济效益要尽可能地降低反应温度
D.及时分离出GeWO4可增大正反应速率
8. 反应E + F G在温度T1下进行,反应M +N
G在温度T1下进行,反应M +N  K在温度T2下进行,已知T1>T2,
且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者的反应速率是( )
K在温度T2下进行,已知T1>T2,
且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者的反应速率是( )
A.前者大 B. 后者大 C.一样大 D.无法确定
7.0.3 mol硼烷(B2H6)气体在氧气中完全燃烧生成B2O3固体和液态水,放出649.5kJ热量。下列判断中正确的是 ( )
A.该反应是非氧化还原反应
B.理论上可以利用该反应的原理设计燃料电池
C.该反应的热化学方程式为B2H6(g)+3O2(g)==B2O3(s)+3H2O(l) △H=+2165kJ·mol-1
D.每生成18 g水,该反应中转移2 mol电子
6.以下是几位同学在学习了化学反应速率和化学平衡理论以后发表的一些看法,其中不正确的是 ( )
A.化学反应速率理论可指导怎样提高原料的转化率
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样在一定时间内快出产品
D.正确利用化学反应速率和化学平衡理论可提高化工生产的综合经济效益
5.已知1 mol白磷变成红磷放出73.56 kJ的热量,有下列两个反应:
P4(白磷,s)+5O2 (g) ==== 2P2O5 (s) △H1
4P(红磷,s)+5O2 (g) ==== 2P2O5 (s) △H2
则△H1和△H2的关系正确的 ( )
A.△H1=△H2<0 B.△H1>△H2>0 C.△H1<△H2<0 D.△H2>△H1>0
4.下列事实中,用勒夏特列原理不能解释的是 ( )
A.实验室制取乙酸乙酯时,边加热边蒸馏以提高乙酸乙酯的产率
B.实验室保存FeSO4溶液时,加入几枚铁钉以防止试剂变质
C.实验室用排水法收集Cl2时,用饱和食盐水代替水以减少Cl2的溶解
D.在SO2的催化氧化反应中,通入过量的空气以提高SO2的利用率
3.下列热化学方程式书写正确的是 ( )
A.C2H5OH(l)+3O2(g)====3H2O(g) +2CO2(g)
△H=-1367.0kJ·mol-1(燃烧热)
B.NaOH (aq)+HCl (aq)==== H2O(l) + NaCl (aq) △H=+57.3kJ·mol-1(中和热)
C.S(s)+O2(g)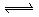 SO2(g)
△H=-296.8kJ·mol-1(反应热)
SO2(g)
△H=-296.8kJ·mol-1(反应热)
D.2NO2====O2+2NO △H=+116.2kJ·mol-1(反应热)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com