
22.20℃时,饱和KCl溶液的密度为1.174 g/cm3,物质的量浓度为4.0mol/L,则下列说法不正确的 
A. 25℃饱和KCl溶液的浓度大于4.0mol/L
B. 此溶液中KCl的质量分数为 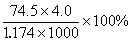
C. 25℃时,密度小于1.174g/cm3的KCl溶液是不饱和溶液
D. 将此溶液蒸发部分水,再恢复到20℃时, 溶液密度大于1.174g/cm3
第Ⅱ卷(56分)
23(14分). 2008年8月6日,美国科研小组宣布,火星的岩层中含有丰富的高氯酸盐,为测定其含量,该科研小组进行如下实验:
①取样品10.0g粉碎,用蒸馏水充分溶解、过滤,将滤液稀释到100 mL。
②取溶液10 mL,用0.01 mol/L的碘水滴定,共消耗40 mL碘水。
根据上述实验步骤完成下列问题:
(1)完成并配平下面方程式:
_______ClO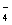 +________I2+________ H2O
+________I2+________ H2O 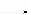 _____Cl-+_______IO
_____Cl-+_______IO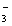 +________□
+________□
(2) 上述实验中的还原剂是_________,被还原的元素是_________,指示剂可选用__________。
(3)与碘水反应的10 mL溶液中ClO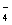 的物质的量浓度为___________;若火星岩层中的高氯酸盐以高氯酸钾存在,其质量分数为(取两位有效数字)__________。
的物质的量浓度为___________;若火星岩层中的高氯酸盐以高氯酸钾存在,其质量分数为(取两位有效数字)__________。
24(13分). A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成气态分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期元素中原子半径最大的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则
(1)B的原子结构示意图为 ;X的化学名称为 ,
(2)B单质的电子式为 ;E的气态氢化物的电子式 ;C与D形成的两种化合物的电子式是 ,其中一种物质含有两种类型的化学键,分别为 ,该物质属于 (填离子化合物或共价化合物)。
(3)B、C、E分别与A形成的化合物中最稳定的是 (写化学式);
(4)D是同周期简单阳离子中离子半径最 的元素;
(5)F的单质在反应中常作 剂(填氧化剂或还原剂)。F的单质属于 晶体(填分子、原子、离子)。
25 (13分)提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
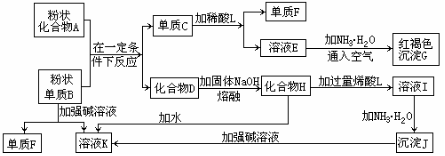
(1)单质F的化学式为_____________________。
(2)溶液I中所含金属离子是___________。 (3)由E生成G的反应类型为_______,_______;A和B的混合物称为______。
(4)写出下列离子方程式: C+L _______________;
H转变成I_________________________________________;
I转变成J_________________________________________;
(5)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)________________。
26(17分).有一无色透明溶液,已知其中可能含有Na+、Fe3+、Mg2+、Cu2+、Al3+、NH4+,取500mL加入一种淡黄色粉末并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示。请回答:
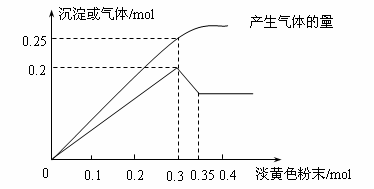
(1)溶液中肯定没有_____________离子,一定含有_____________离子;这些离子的浓度分别为_________________________________。。
(2)①淡黄色粉末与水反应的化学方程式为__________________________。
②沉淀部分减少时的离子方程式为_____________________________。
(3)溶液中可能含有______离子,检验该离子的方法为_________________。
福州八中2009-2010高三毕业班第二次质量检查
21.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是:
A.烧杯中有铜无铁 B.烧杯中有铁无铜 
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
20.研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到的直观形象的效果。下列表达不正确的是
A.密闭容器中CuO和C高温反应的气体产物:

B.Fe在Cl2中的燃烧产物: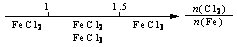

C.AlCl3溶液中滴加NaOH后铝的存在形式: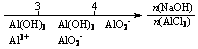

D.氨水与SO2反应后溶液中的铵盐: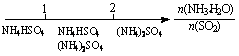

19.下列除去杂质的方法正确的是

|
|
物 质 (杂 质) |
除 杂 方 法 |
|
A |
NaHCO3(Na2CO3) |
加入氢氧化钙溶液 |
|
B |
FeCl2溶液(FeCl3) |
通入氯气 |
|
C |
氢氧化铁胶体(FeCl3) |
将混合物直接过滤 |
|
D |
FeCl2溶液(Cu Cl2) |
加铁粉后过滤 |
18.除稀有气体外,目前人类已发现的非金属元素共有16种。下列对这16种非金属元素的相关判断正确的是
①都是主族元素,最外层电子数均大于4 ②单质在反应中都只能作氧化剂,具有强氧化性 ③其中碳、氮形成的氢化物常温下都是气态 ④氧化物都是酸性氧化物
A.只有①正确 B.只有①③正确 
C.只有③正确 D.①②③④均不正确
17.从海水(含氯化镁)中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳[Ca(OH)2]; ②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物; ③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物; ④将得到的产物熔融电解得到镁。下列说法不正确的是 
A.此法的优点之一是原料来源丰富
B.①②③步骤的目的是从海水中提取MgCl2
C.以上提取镁的过程中涉及分解、化合和复分解反应
D.第④步电解时阴极产生氯气
16.某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键是

A.一定是离子键 B.一定是共价键 
C.可能是离子键,也可能是共价键 D.以上说法都不正确
15.若某溶液中有Fe2+和I-共存,要氧化I-而又不氧化Fe2+,可加入的试剂是
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
14.2008年北京奥运会主体育场--“鸟巢”,被《泰晤士报》评为全球 “最强 悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。有关说法正确的是
悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓高亮度LED材料。有关说法正确的是
A.用金属铝与V2O5冶炼钒,铝作还原剂
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.合金的熔点通常比组分金属高,硬度比组分金属小
D.ETFE膜( )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
13.已知Cl-、Fe2+、H2O2、I-、SO2均具有还原性,且在酸性溶液中的还原性依次增强。下列各反应不能发生的是 
A.H2O2
+ H2SO4 = SO2 + O2 + 2H2O 
B.2Fe3+
+SO2 + 2H2O = 2Fe2+ + SO42
- + 4H+
C.2 Fe2+
+ Cl2 = 2Fe3+ + 2 Cl- 
D.I2 +
SO2 + 2H2O = H2SO4 + 2HI
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com