
(原创题)下图是“建国以来我国城乡人口变化情况”,读图回答1-3题。
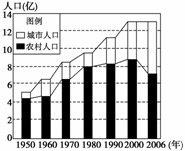
1.衡量城市化水平最重要的标志是 ( )
A.城市人口的不断增长 B.城市人口占总人口的比重
C.城乡人口比值的大小 D.城市用地规模占土地总面积的比重
2.目前,我国城市化进程正处于下列哪个阶段 ( )
A.初期缓慢发展阶段 B.中期加速阶段
C.后期成熟阶段 D.条件不足,不能判断
3.总体来看,近年我国城市和乡村人口增长速度存在着明显差异,造成这种差异的主要原因是 ( )
A.城乡人口出生率不同 B.城乡人口死亡率不同
C.城乡之间的人口迁移 D.城乡人口的从业性质不同
答案 1.B 2.B 3.C
18.目前一种新型抗酸剂能迅速改善和缓解胃酸过多等疾病,它主要由碳酸镁、氢氧化镁和氢氧化铝组成。现取一定量样品,加入50mL 3.6 mol•L―1盐酸,正好完全反应,放出标准状况下224mL二氧化碳气体,再向反应后的溶液中加入过量烧碱溶液,过滤,灼烧沉淀,得2.4g白色固体。试求该样品中三种主要成分质量。
17.已知某无色透明的溶液中含有的离子仅是NH4+,Cl-等4种离子。请回答下列问题。
(1)该溶液所含的离子中除了上述两种外,还应有 两种离子(填离子符号)。
(2)该溶液所含的上述4种离子的物质的量浓度大小之间的关系是否只有一种可能?
(填“是”或“否”)
(3)请你用离子浓度符号(例c(NH4+)“>”“<”“=”等符号),将这4种离子的物质的量浓度按从大到小的顺序把它们大小之间的关系的各种可能都表示出来(有多少种填多少种,可以不填满也可以自己增加)。并将相对应的溶液中溶质的化学式也填在横线上。
① ,
② ,
③ ,
④ ,
⑤ ,
⑥ ,
,
16.已知某溶液只存在OH-、H+、NH4+、Cl-、四种离子,某同学推测其离子浓度大小顺序有如下四种关系:①c(Cl-)>c(NH4+)>c(H+)>c(OH-),②c(Cl-)>c(NH4+)>c(OH-)>c(H+),③c(NH4+)>c(Cl-)>c(OH-)>c(H+),④c(Cl-)>c(H+)>c(NH4+)>c(OH-)。填写下列空白:⑴ 若溶液中只溶解了一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为 (填序号);⑵ 若上述关系中③是正确的,则溶液中的溶质是 ;若上述关系中④是正确的,则溶液中的溶质是 ;⑶ 若该溶液是由体积相等的盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) c(NH3•H2O)(填“大于”、“等于”、“小于”),混合前酸中c(H+)和c(OH-)的关系c(H+) c(OH-)。
15.⑴ 元素A、B位于元素周期表中同一短周期。已知相同温度下等物质的量浓度的AClx溶液的pH小于BClY溶液的pH,则A的原子序数 B的原子序数,x y;
⑵ 将一定量氨气通入盐酸中,溶液的pH恰好为7(25ºC),则氨气的物质的量 盐酸中HCl 的物质的量;溶液中c (NH4+) c (Cl-);
⑶ 向同体积、同物质的量浓度的盐酸和氯化铵溶液中,加入等质量的镁粉,镁粉完全反应后,盐酸放出气体的体积 氯化铵溶液放出气体的体积;
⑷ 向等体积pH=10的NaOH溶液和pH=10的NaCN溶液中不断的滴加同浓度的稀盐酸至pH=9,消耗盐酸的体积:前者 后者(以上均用“<、>、=”填空 )。
14.A、B、C、D均为4种常见的短周期元素,常温下A、B可形成两种常见的液态化合物,其最简式分别为BA和B2A;B与D可形成分子X,也可形成阳离子Y,X、Y在水溶液中酸、碱性正好相反;C+的焰色反应呈黄色。
⑴ C元素在周期表中的位置是 ;液态X类似B2A,也能微弱电离且产生电子数相同的两种离子,则液态X电离方程式为 。
⑵ M、N是由A、B、C、D四种元素中任意三种元素组成的不同类型的强电解质,M的水溶液呈碱性,N的水溶液呈酸性,且M溶液中水的电离程度小于N溶液中水的电离程度。 则M、N分别为(填化学式) ;若将0.1mol·L-1M和0.2mol·L-1N两溶液等体积混合所得溶液中离子浓度的大小顺序为 。
13.泡沫灭火剂包括Al2(SO4)3溶液(约1 mol·L-1)、NaHCO3溶液(约1 mol·L-1)及起泡剂。使用时发生的化学反应方程式是____________,Al2(SO4)3溶液和NaHCO3溶液的体积比约是________。若用等体积、等物质的量浓度(mol· L-1)的Na2CO3溶液代替NaHCO3溶液,在使用时喷不出泡沫,这是因为________;若用固体NaHCO3代替NaHCO3溶液,在使用时也喷不出泡沫,这是因为________。泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,不能把硫酸铝溶液盛在铁筒里的原因是____________。
12.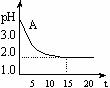 电解氯化铜溶液时,实验测得其溶液的pH变化如图所示:下列有关说法中不正确的是( )
电解氯化铜溶液时,实验测得其溶液的pH变化如图所示:下列有关说法中不正确的是( )
A.电解氯化铜溶液的方程式为:CuCl2 Cu+Cl2↑
Cu+Cl2↑
B.在电解过程中,溶液中H+ 浓度逐渐减小
C.随着电解的进行,溶液中Cu2+ 浓度逐渐减小,由Cu2+ 水解产生的H+ 越来越少
D.电解时阳极上产生的氯气溶于水,生成HClO和HCl,使氢离子浓度增大,pH变小
11.某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。下列有关叙述中正确的是( )
A. HY-的水解方程式为:HY-+ H2O H3O+
+ Y2-
H3O+
+ Y2-
B. H2Y的电离方程式为:H2Y+ H2O HY-+ H3O+
HY-+ H3O+
C.在该酸式盐溶液中,离子浓度的大小关系为:c(Na+)>c(HY-)>c(OH-)>c(H+)
D.在该酸式盐溶液中,离子浓度的大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
10.常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH=7,且c(CH3COO-)>c(Na+)>c(H+)=c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com