
5、 NaOH:
阴极: 阳极
总方程式: 电解质浓度 ,pH
4、CuSO4阴极: 阳极
总方程式: 电解质浓度
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
小结:经过总方程式发现该电解池反应的电解对象是 ,这一类电解反应称为放O2生酸型。
3、NaCl阴极: 阳极
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
小结:经过总方程式发现该电解池反应的电解对象是 ,这一类电解反应称为放H2生碱型。
2、 HCl:
阴极: 阳极
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
小结:经过总方程式发现以上两个电解池反应的电解对象都是 ,这一类电解反应称
为电解电解质型
1、CuCl2阴极: 阳极
总方程式: 电解质浓度 ,pH
电解对象: ,要把电解质溶液复原,加 。
5、放电顺序
阴极上:
由于阴极上要 电子,不管阴极材料是金属还是石墨,此时都不能得电子,因此只能是溶液中的 得电子。阳离子氧化性越强就越 得电子。
因此阴极上氧化性强的离子 得电子。
金属越不活泼,对应阳离子氧化性越 ,越 得电子。
由此根据金属活动顺序表,分析下列离子得电子能力的强弱:
金属活动顺序表
Ag+ Cu2+ H+(酸) Pb2+ Fe2+ Zn2+ H+(水) Al3+…
严格讲:离子的放电能力与其浓度也有一定的关系,如酸溶液中:c[H+(酸)]>c[ H+(水)],因而放电能力 > 。但在中学范围内一般不考虑上述金属离子浓度对其放电能力的影响。
、 、 、 、 、 等活泼金属阳离子在水溶液中电解时不得电子。
小结:质量增加,或有氢气产生的电极一定是 极。
阳极上:
电解池中阳极上要 电子,而 与溶液中的 都可失电子,因此阳极上的电极反应与 有关。由于一般的 比阴离子更容易失去电子,因此如果用一般的金属材料做阳极,电解时阳极上是 失去电子。而阳极如果用石墨或金属铂(Pt)等难失电子的物质做惰性电极时,则是溶液中 失去电子。阴离子还原性越强就越 失去电子。根据非金属性的强弱,分析下列离子失电子能力的强弱:
S2- I- Br- Cl- OH-(水或碱) 最高价含氧酸根离子 F-。
从CuCl2溶液的电解产物可知: 的失电子能力比 强。而氟原子的得电子能力很 ,因而F-失电子能力最 。
研究表明:OH-的失电子能力比最高价含氧酸根离子强:
4OH-- 4e-=O2 ↑+2H2O
、 等阴离子在水溶液中电解时不失电子。
注意:放电顺序这个考点不难,但要细心,极易出错。要能根据放电顺序判断阴、阳极产物,如果是惰性电极则直接考虑溶液中离子的放电顺序。如果阳极是较活泼金属,那一定要能想起:一般的 比阴离子更容易失去电子,因此如果用一般的金属材料做阳极,电解时阳极上是 失去电子。
练习:一、用惰性电极电解下列电解质溶液,请你分析下列问题(注意得失电子的顺序)
4、原电池与电解池的比较
|
装置类别 |
原电池 |
电解池 |
||
|
举例(图) |
|
|
||
|
电极名称 |
|
|
|
|
|
反应类型 |
|
|
|
|
|
能量转变 |
|
|
||
|
反应是否自发进行 |
|
|
在CuCl2的电解池装置中,电子流动方向从电源的 极沿着导线到达 极,从 极沿着导线回到电源的 极。
在溶液中电子有没有从阴极直接到达阳极呢? 。溶液中的 在电场作用下到达阴极,得到从电源负极流出的电子;溶液中的 在电场作用下到达阳极,失去了电子流向电源的正极。就是说:在电解质溶液中依靠 的定向移动而形成闭合回路的。
对CuCl2溶液而言,溶液中是否只有Cu2+和Cl-两种离子呢? 。水电离出少量的H+和OH--在电场作用下是否也要做定向移动呢? 。通电时,溶液中的
两种离子都要向阴极移动, 都要向阳极移动。
3、电解池:将 能转化为 能的装置。
构成电解池的条件:
① ②
③ ④
判断下列装置是否属于电解池:

2、电解:使电流通过 溶液而在阴、阳两极引起 的过程。
所用电流一般为直流电还是交流电较好? !该过程中 能转化为 能! 这是一个物理过程还是一个化学过程? 过程!显然:电解质溶液的导电过程就是 的过程。
1、试验探究
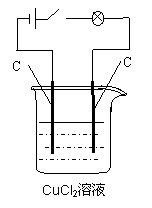 如图所示:与电源正极相连的电极叫 极,
如图所示:与电源正极相连的电极叫 极,
与电源负极相连的电极叫 极。
若烧杯中的液体为CuCl2溶液,合上电源开关,
能否看到小灯泡发光? 。
给CuCl2溶液通电时现象:
阴极上 ,
经检验该物质是 。
阳极上: ,
经检验该物质是 。
两支电极上发生的反应为:
阳极: 。反应类型: 反应。
阴极: 。反应类型: 反应。
总反应式: 。
过程分析:CuCl2溶液能导电是因为存在 ,通电后这些自由移动的离子,在电场作用下作 移动,根据 相互吸引的原理,带负电的氯离子向 极移动,在阳极,氯离子失去电子被 为氯原子,并两两结合成氯分子,从阳极放出,带正电的铜离子向 极移动,在阴极铜离子获得电子被 成铜原子,覆盖在阴极上。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com