
4.25℃时将等体积盐酸和氨水混合,若混合溶液中[NH4+]=[Cl-],则溶液的pH值( )
A.>7 B.<7 C.=7 D.不能确定
3.用物质的量都是0.1 mol 的HCN和NaCN混合后配成1 L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是( )
A.c(H+)>c(OH-)
B.c(HCN)>c(CN-)
C.c(CN-)+c(OH-)=0.1 mol·L-1
D.c(HCN)+c(CN-)=0.2 mol·L-1
2.物质的量相同的下列溶液中,含粒子种类最多的是( )
A.CaCl2 B.CH3COONa
C.NH3 D.K2S
1.(06理综天津)下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
5.现有电解质溶液:①Na2CO3、②NaHCO3、③NaAlO2、 ④CH3COONa、⑤NaOH,且已知:CO2+3H2O+2AlO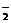 ====2Al(OH)3↓+CO
====2Al(OH)3↓+CO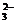 。
。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为________________。
[课后作业]
4.草酸(H2C2O4)是二元弱酸,草酸氢钾溶液呈酸性。在O.1mol·L-1 KHC2O4溶液中,下列关系正确的是 ( CD )
A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) B.c(HC2O4-)+c(C2O42-)=0.1 mol·L-1
C.c(C2O42-)>c(H2C2O4) D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)
3.在相同物质的量浓度的下列盐溶液中,c(NH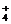 )最大的是
)最大的是
A.NH4HSO4 B.NH4HCO3
C.CH3COONH4 D.NH4Cl
2.(06理综四川卷) 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-) = c(NH4+)+c(H+)
1. (06江苏卷)下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu===Fe2++Cu2+
2. 常见酸式盐溶液的酸碱性
①若只有电离而无水解,则呈 性(如NaHSO4)
②若既有电离又有水解,取决于两者程度的相对大小
电离程度>水解程度,呈 性;NaHSO3、NaH2PO4。
电离程度<水解程度,呈 性;NaHCO3、NaHS、Na2HPO4。
[典型例题]
[例1]室温下0.1mol/L NH4CN溶液的pH等于9.23。下列说法不正确的是
A.上述溶液能使甲基橙试剂变为黄色
B.室温下,NH3·H2O是比HCN更弱的电解质
C.上述溶液中CN-的水解程度大于NH4+的水解程度
D.室温下,0.1mol/L NaCN溶液中,CN-的水解程度小于上述溶液中CN-的水解程度。
提示:从pH等于9.23,溶液呈碱性入手,比较NH4+及CN-水解程度的大小。
[例2](2004年全国理综,7)物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
A.Na2CO3 NaHCO3 NaCl NH4Cl
B.Na2CO3 NaHCO3 NH4Cl NaCl
C.(NH4)2SO4 NH4Cl NaNO3 Na2S
D.NH4Cl (NH4)2SO4 Na2S NaNO3
提示:A、B两项溶液相同,NH4Cl属于强酸弱碱盐,水溶液呈酸性;NaCl属于强酸强碱盐,溶液呈中性;NaHCO3和Na2CO3溶液均呈碱性,且NaHCO3的碱性小于Na2CO3的碱性,排列顺序为:NH4Cl、NaCl、NaHCO3、Na2CO3,故A、B均错误;C、D溶液种类相同,其pH由小到大的顺序为(NH4)2SO4,NH4Cl、NaNO3、Na2S,故C项正确,D错误。
[例3] 由一价离子组成的四种盐:AC、BD、AD、BC的1 mol·L-1的溶液,在室温下前两种溶液的pH=7,第三种溶液pH>7,最后一种溶液pH<7,则
|
|
A |
B |
C |
D |
|
碱性 |
AOH>BOH |
AOH<BOH |
AOH>BOH |
AOH<BOH |
|
酸性 |
HC>HD |
HC>HD |
HC<HD |
HC<HD |
提示:正盐水解后对溶液酸碱性的影响可以归纳为“有弱就水解,越弱越水解,谁强显谁性,无弱显中性”,这里的“弱”是指盐中的弱碱阳离子或弱酸根离子,“越弱”是指对应的碱或酸的电离程度。
由AD溶液的pH>7,可知AOH的电离程度大于HD,由BC溶液的pH<7,可知BOH的电离程度小于HC,同理由AC、BD溶液的pH=7,可知AOH与HC、BOH与HD的电离程度相同。故有电离程度HC=AOH>HD=BOH,即HC的酸性大于HD,AOH的碱性大于BOH。
[当堂反馈]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com