
10. 通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。请回答:
(1)用化学符号表示下列4种微粒:
A: ; B: ;C: ;D: 。
(2)写出A、B、E三种微粒反应的离子方程式: 。
[答案](1)H2O NH3 NH4+ OH-
(2)Al3++3NH3+3H2O=Al(OH)3↓+3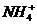 ,
,
Mg2++2NH3+2H2O=Mg(OH)2↓+2NH4
[解析]常见核外电子总数为10个电子的微粒共有15种。阳离子有:Na+、Mg2+、Al3+、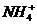 、H3O+;阴离子有:N3-、O2-、
、H3O+;阴离子有:N3-、O2-、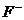 、
、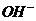 、NH2-;分子有:Ne、HF、H2O、NH3、CH4。根据题意知B溶于A后所得的物质可电离出阳离子C和阴离子D,可知A为H2O,B为NH3,氨气溶于水生成的一水合氨电离出
、NH2-;分子有:Ne、HF、H2O、NH3、CH4。根据题意知B溶于A后所得的物质可电离出阳离子C和阴离子D,可知A为H2O,B为NH3,氨气溶于水生成的一水合氨电离出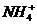 和
和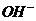 离子。第(2)问带有一定的开放性,一种10电子的阳离子能和氨水反应生成沉淀和铵根离子,这种阳离子可以是Mg2+也可以是Al3+
离子。第(2)问带有一定的开放性,一种10电子的阳离子能和氨水反应生成沉淀和铵根离子,这种阳离子可以是Mg2+也可以是Al3+
9. 分析化学中常用X射线研究晶体结构,有一种蓝色晶体可表示为:[MxFey(CN)z],研究表明它的结构特性是Fe2+、Fe3+分别占据立方体的顶点,自身互不相邻,而CN一位于立方体的棱上,其晶体中的阴离子晶胞结构如图示,下列说法正确的是
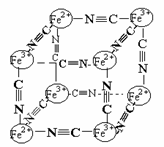
A.该晶体是原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+的占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
[答案]C、D 这是一道非常新颖的结合有机的晶体题。首先根据结构粒子是离子,可确定该晶体为离子晶体,并非原子晶体。观察阴离子晶胞可知,Fe2+、Fe3+共占据8个顶点,平均分摊到4×1/8=1/2个,CN-在棱上,分摊到12×1/4=3个,再根据阴阳离子所带电荷,可确定晶胞中阴离子组成为:[Fe(CN)3]0.5-,扩大两倍(相当于两个阴离子晶胞)得[Fe2(CN)6]-,显见,所对应的阳离子只能为+1价,形成M2[Fe2(CN)6],即两个晶胞共有1个M+阳离子,根据晶胞知识,其只能位于体心,且每两个晶胞中一个有M+,另一个必无,即空缺率为50%。故答案应选C和D
8. 元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有
A. 能与水反应 B. 能与氢氧化钠反应
C. 能与硫酸反应 D. 能与碳酸钠反应
[答案] BD
7.右图表示元素周期表前四周期的一部分,关于元素X、Y、Z、W的叙述正确的是
|
|
|
||
|
X |
|
|
|
|
Y |
Z |
|
|
|
|
|
W |
|
①X、Y的最高价氧化物的水化物酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
A.只有③ B.①②
C.①②③ D.①②③④
[答案]C
6.(07北京理综)X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.X与Y的简单离子不可能具有相同的电子层结构
C.两元素形成的化合物中,原子个数比不可能为1︰1
D.X2Y可能是离子化合物,也可能是共价化合物
[答案]D
5. 表中①-⑥为短周期元素及相应部分原子半径的数据:
|
元 素 性 质 |
元 素 编 号
|
|||||
|
① |
② |
③ |
④ |
⑤ |
⑥ |
|
|
原子半径(nm) |
a |
0.075 |
b |
0.110 |
c |
d |
|
最 高 化 合 价 |
+6 |
+5 |
|
+5 |
|
+7 |
|
最 低 化 合 价 |
-2 |
-3 |
-2 |
-3 |
-1 |
-1 |
下列说法正确的是( )
A. 元素①的最外层电子排布为2S22P4
B. 元素②氢化物与元素⑥氢化物之间反应形成化合物中只有极性键
C. 原子半径:a>d>b>c
D. 非金属性:元素⑤>元素④>元素①
[答案]C
[解析]先从化合价角度分析,最高正价为最外层电子数,最低价的绝对值为8减最外层电子数。元素①和元素③同在ⅥA族,由于O无最高正价,可确定元素①为S和元素③为O元素;元素②和元素④同在ⅤA族,半径大小②< ④,马上确定元素②为N元素④为P元素;元素①的最外层电子排布为3S23P4;NH3与HCl生成NH4Cl中含有离子键和极性键;原子半径大小应为S>Cl>O>F,即a>d>b>c;非金属性:元素⑤>元素①>元素④,即F>S>P。选C
4. 下列说法中正确的是( )
A. 非金属原子组成的化合物不可能是离子化合物
B. ⅠA族元素的金属性一定比ⅡA族元素的金属性强
C. 同一主族元素组成的化合物一定是共价化合物
D. NH5中的所有原子的最外层都符合相应稀有气体原子电子层结构,1molNH5中含有4NA个N-H键(NA表示阿伏加德罗常数的值)
[答案]D
3.A、B、C、D、E均为短周期元素。A、B、C位于同一周期相邻位置,它们分别与D形成的分子中都有10个电子,且A和C的原子序数之比为3︰4。E原子半径是短周期元 素原子半径最大的。则下列叙述正确的是
A.A和C能形成共价化合物
B.由B、D原子构成的分子的结构是正四面体
C.E和C只能形成E2C 一种化合物
D.由A、B、C、D四种元素形成的化合物一定不属于无机盐
[答案]A
2.下列叙述正确的是
A.原子晶体中只存在非极性共价键
B.干冰升华时,分子内共价键会发生断裂
C.由原子构成的晶体可以是原子晶体,也可以是分子晶体
D.只要含有金属阳离子的晶体就一定是离子晶体
[答案]C
1. 短周期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是
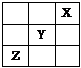 A. X是活泼的非金属
A. X是活泼的非金属
B. 三种元素中Y的非金属性最强
C. Z的最高价氧化物的水化物是强酸
D. Y的最高价氧化物的水化物是一种强酸
[答案]BC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com