
4.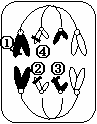 某高等生物基因型为AaBb,经减数分裂能产生四种数量相等的配子。下图为其体内的某个细胞,则
某高等生物基因型为AaBb,经减数分裂能产生四种数量相等的配子。下图为其体内的某个细胞,则
A.该状态下的细胞发生了基因重组
B.②与④上的基因分离体现了分离定律
C.图中基因位点①、②、③、④可能分别是A、b、B 、b 
 D.该状态下的细胞含有4个染色体组,其中②和③所在染色体
D.该状态下的细胞含有4个染色体组,其中②和③所在染色体
组成一个染色体组

3.在一群人中,64%的人可以卷舌,人的这一能力由一个显性基因控制,而且在一段时间内,这个群体的基因频率和基因型频率前后代可以维持不变。则一个卷舌者与一个非卷舌者结婚,婚后预计这对夫妇生一个卷舌的孩子的概率是
A.1/8 B.1/4 C.3/8 D.5/8
2.某有机分子的分子式为C22H34O13N6,其水解后共产生下列3种氨基酸
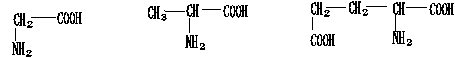

甘氨酸
丙氨酸
谷氨酸
据此判断,下列正确的一项是
A.在细胞中合成1个这样的分子至少需要3种tRNA 
B.合成1个这样的分子同时将产生6个水分子
C.该分子中存在一个游离氨基和一个游离羧基
D.1个这样的分子水解后可以产生2个谷氨酸
1.关于图示DNA分子的说法,正确的是
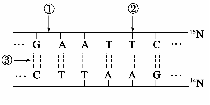







A.限制性核酸内切酶可作用于①部位,DNA连接酶作用于部位③
B.该DNA的特异性表现在碱基种类和(A+T)/(G+C)的比例上
C.若该DNA中A为P个,占全部碱基的n/m(m>2n),则G的个数为(pm/2n)-P
D.把此DNA放在含15N的培养液中复制两代,子代中含15N的DNA占3/4
16. U、V、W、X、Y为短周期元素,且原子半径依次增大,U、V同主族,V、W、X、Y处于同周期,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,Z为血红蛋白中所必需的金属元素,且U、W、Z分别能与氧元素形成U203、W2O3、Z2O3。
回答下列问题:
(1)U的气态氢化物分子的电子式为 。盐A中阳离子的检验方法是
。
(2)1molV的最高价氧化物对应的水化物与3 molKOH恰好完全反应,其产物的化学式为 。
(3)W的单质与Y的最高价氧化物对应的水化物的溶液反应,其离子方程式是 .
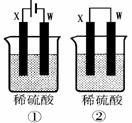
(4)如下图所示的两个实验装置中,溶液的体积均为100mL,开始时硫酸溶液的浓度均为0.055mol/L,工作一段时间后。测得导线中均通过0.01mol电子(若不考虑盐的水解和溶液体积的变化)。①中溶液的pH为 :②中X电极质量改变量为
(5)z单质与水在一定条件下反应的化学方程式为 。
[答案]⑴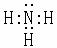 (2分)取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子。(2分)
(2分)取少量A于试管中,加入氢氧化钠溶液,加热,产生一种能够使湿润的红色石蕊试纸变蓝的气体,则证明阳离子是铵根离子。(2分)
⑵K3PO4、H2O(2分)
⑶2Al+2OH-+2H2O = 2AlO2-+3H2↑(2分)
⑷2(2分)0.12g(2分)
⑸3Fe+4H2O Fe3O4+4H2↑(2分)
Fe3O4+4H2↑(2分)
[解析]U是突破口,因为其最高价氧化物对应水化物与其气态氢化物反应生成盐,U为氮元素,A为NH4NO3,U、V同主族,V为磷元素,V、M、X、Y处于同周期,且原子半径依次增大,四种元素在周期表中按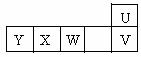 顺序依次排列,又因为U、W、Y最高价氧化物对应水化物之间能发生反应生成盐,所以W为铝,Y为钠,X在中间为镁。Z为血红蛋白中必需元素,Z为Fe。
顺序依次排列,又因为U、W、Y最高价氧化物对应水化物之间能发生反应生成盐,所以W为铝,Y为钠,X在中间为镁。Z为血红蛋白中必需元素,Z为Fe。
装置①为电解池,阳极Mg-2e-=Mg2+,阴极2H++2e-=H2,电路中通过电子0.01mol,有0.01molH+得电子被还原。c(H+)=(0.055*0.1*2)/0.1=0.01mol/L,溶液的pH=2
装置②为原电池,Mg为负极,发生反应Mg-2e-=Mg2+,电路中通过电子0.01mol,负极Mg减少0.01/2=0.005mol,质量减少0.005*24=0.12g。
Fe在高温条件下与水蒸气反应生成Fe3O4和H2。
15. 短周期主族元素A、B、C、D、E的原子序数依次增大,它们的原子核外电子层数之和为10;B的化合物种类繁多,数目庞大。C、D是空气中含量最多的两种元素;D、E两单质可以生成两种不同的离子化合物
(1)写出E的单质与A、D两元素形成其常见化合物反应的离子方程式
________________________。
(2)由A、C、D三元素所形成的常见盐与氢氧化钠反应的方程式为_________________
(3)B的相对分子质量最小的氢化物,写出其化学式___________。
(4)X、Y是均由C、D两元素组成的化合物,且C、D在X、Y中的价态相同,某温度下相互转化时的量变关系如下图:
|
|
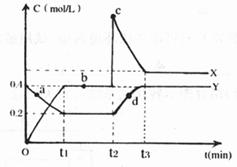
(I)X的化学式是___________
(II)图中a、b、c、d四点中,表示反应处于平衡状态的是___________
(III)反应进行到t2时刻,改变的条件可能是___________
[答案](1)2Na+2H2O=2Na++OH-+H2↑ (2分)(2)NH4NO3+NaOH=NaNO3+ NH3·H2O (2分)
(3)CH4(1分)(4)(I)NO2(1分)(II)b(1分)(III)增大NO2的浓度(合理)(1分)
[解析]先推测这5种元素,B的化合物种类繁多,数目庞大,B为碳元素,C、D是空气中含量最多的两种元素,所以C是氮元素,D是氧元素,D、E两单质可以生成两种不同的离子化合物,则E是钠元素,生成的两化合物为Na2O、Na2O2,根据五种元素的原子核外电子层数之和为10,得到A元素是H,(1)即为钠和水的反应:2Na+2H2O=2Na++OH-+H2↑;(2)A、C、D三元素所形成的常见盐为NH4NO3;(3)B的相对分子质量最小的氢化物是CH4(4)(I)由题意可知,两种氮的氧化物价态相同,则为NO2、N2O4.根据t1时刻的数据,△C(Y)=0.2mol·L-1,△C(X)=0.4mol·L-1,由反应:N2O4 2NO2,物质的量浓度的变化之比等于计量数之比,所以X是NO2,Y是N2O4(II)a、b、c、d四点中,b点时,两物质的浓度都没有变化,在平衡状态;反应进行到t2时刻,NO2的浓度迅速增大,然后逐渐减小,N2O4的缓慢增大,平衡向着生成N2O4的方向移动。改变条件为增大NO2的浓度
2NO2,物质的量浓度的变化之比等于计量数之比,所以X是NO2,Y是N2O4(II)a、b、c、d四点中,b点时,两物质的浓度都没有变化,在平衡状态;反应进行到t2时刻,NO2的浓度迅速增大,然后逐渐减小,N2O4的缓慢增大,平衡向着生成N2O4的方向移动。改变条件为增大NO2的浓度
14.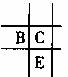 已知aA、bB、cC、dD、eE均为短周期元素,且原子序数依次增大。已知A、D同主族,A与其他元素均不同周期,B、C、E三种元素在周期表中的位置如图所示,且BC对应的单质在常温下为无色气体。请回答下列问题:
已知aA、bB、cC、dD、eE均为短周期元素,且原子序数依次增大。已知A、D同主族,A与其他元素均不同周期,B、C、E三种元素在周期表中的位置如图所示,且BC对应的单质在常温下为无色气体。请回答下列问题:
(1)A、B形成的四原子核化合物属于__________(填“极性”或“非极性”)分子,其易液化,原因是___________________________。
(2)由A、C两元素组成的三种10电子微粒是___________、____________、_______________
(3)甲是由A、C两元素形成的常见四原子核化合物,乙是由A、C、E形成的六原子
核化合物,乙的水溶液和甲的水溶液相互反应的化学方程式为
_____________________________。
(4)从五种元素中任选三种元素,组成化合物X和Y,在下列表格中按要求填写相应的化学式(每空只写一种即可)。
|
X pH>7(25℃) |
Y pH<7(25℃) |
|
抑制水的电离:____________________ |
抑制水的电离:____________________ |
|
促进水的电离:____________________ |
促进水的电离:____________________ |
[答案](1)极性;分子间存在氢键(2)H2O;OH-;H3O+(3)H2O2+H2SO3=H2SO4+H2O
(4)
|
X pH>7(25℃) |
Y pH<7(25℃) |
|
NaOH |
H2SO4 |
|
NaHS |
NH4NO3 |
[解析]A与其他元素不同周期且原子序数最小,A为H,与之同主族元素D为Na,根据B、C、E在周期表中位置以及B、C的颜色状态,B为N,C为O,因此推断E为S。
所以A、B形成的四原子核化合物为NH3,极性分子,由于分子间存在氢键,沸点较高,容易液化。A、C组成的3种10电子微粒为H2O、OH-、H3O+。其中A和C组成的4原子核化合物为H2O2,具有氧化性,A、C、E形成的六原子核化合物具有还原性的为H2SO3,二者反应生成H2SO4。任选三种元素组成化合物,其中抑制水电离的为酸或者碱,如NaOH,H2SO4、HNO3等,促进水的电离的化合物为能水解的盐,如Na2SO3、NaHS、NH4NO3等。
13. 有关元素A、B、C、D、E的信息如下
|
元素 |
有关信息 |
|
A |
元素主要化合价为-2,A的一种氢化物可用于实验室制取A的单质 |
|
B |
所在主族序数与所在周期序数之差为4 |
|
C |
原子中含10个P电子 |
|
D |
最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
|
E |
生活中常见金属,它有两种氯化物,相对原子质量相差35.5 |
请回答下列问题:
(1)元素A-E中两种元素组成的化合物使品红溶液褪色的物质的化学式为
_____________
(2)E元素与B元素可形成EB2和EB3两种化合物,下列说法正确的是(填序号)________。
①保存EB2溶液时,需向溶液中加入少量E单质
②EB2只能通过置换反应生成,EB3只能通过化合反应生成
③铜片、碳棒和EB3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴EY3的浓溶液,原无色溶液都变为紫色
(3)用化学符号表示D2C的水溶液中各粒子的浓度关系,如c(C2-)=______________。
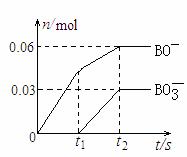
(4)将一定量的B单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中含有三种含B元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如下图所示。该苛性钾溶液中KOH的质量是___________,该反应中转移电子的物质的量是_________。
(5)工业上冶炼E单质的化学方程式为__________________________________
[答案](1)SO2、Na2O2
(2)①③
(3)c(S2-)= 1/2[c(Na+)+c(H+)- c(HS-)-c(OH-)]或c(S2-)= 1/2c(Na+)- c(HS-)-c(H2S)(其它合理答案也可)
(4)16.8g 0.21mol
(5)Fe2O3+3CO 3CO2+2Fe
3CO2+2Fe
[解析]根据题给信息A为氧元素,实验室可以用双氧水来制备氧气;所在主族序数与所在周期序数之差为4,B元素为氧或者氯,因为A为氧,所以B为氯元素;C元素原子中含10个P电子,P电子一定为2p63p4,C元素为硫;最高价氧化物对应水化物,能电离出电子数相等的阴、阳离子,由于Mg(OH)2、Al(OH)3难溶,所以该物质为NaOH,D为钠元素;E有两种氯化物,相对原子质量相差35.5,E有变价,为Fe元素。
(1)漂白性物质包括化合漂白和氧化性漂白等,这几种元素中的两种元素形成的具有漂白性的物质有SO2、Na2O2
(2)FeCl2可以通过化合反应制得,如:2FeCl3+Fe=3FeCl2,FeCl3可以通过分解反应制得如2Fe(OH)3=Fe2O3+3H2O;淀粉碘化钾溶液中滴加几滴FeCl3的浓溶液,溶液呈蓝色,苯酚溶液中滴加几滴FeCl3的浓溶液,溶液显紫色,正确的说法为①③。
(3)在Na2S溶液中,根据电荷守恒有:2c(S2-)+ c(HS-)+c(OH-)= c(Na+)+c(H+),根据物料守恒有:c(Na+) = 2 [c(S2-)+c(HS-)+c(H2S)],变形即可。
(4)根据得失电子守恒,Cl2与KOH反应生成KClO、KClO3外,还有KCl生成,依据ClO-和ClO3-的物质的量配平方程式,有
5Cl2+10KOH=7KCl+2KClO+KClO3+5H2O,转移电子0.03*7=0.21mol,反应消耗KOH的质量为0.03*10*56=16.8g。
(5)工业炼铁是用CO还原铁矿石制得
12.A、B、C、D、E均为短周期元素,且原子序数依次增大。已知B元素在自然界中组成化合物的种类最多;D原子最外层电子数与核外电子数之比为3:4;A与D、E与D均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由A、C、D三种元素可组成多种化合物,写出其中两种常见化合物的化学式
、 。
(2)在C和B组成化合物 (CB)2中,C、B原子均满足最外层8电子结构,,则(CB)2的电子式是 。
(3)化合物E3C与水反应的原理和碳化钙与水反应的原理相同,写出E3C与盐酸反应的化学方程式 。
(4)已知B与A可组成化合物甲,D与A可组成化合物乙,每个甲、乙分子中均含有18个电子
① 甲在过量的D单质中充分燃烧,燃烧热是1559 kJ / mol,写出该反应的热化学方程式 。
② 在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1mol Fe2+被氧化成Fe3+
时,反应中电子转移为4 mol,写出该反应的离子方程式
。
[答案]
(1)HNO3、NH4NO3(其他合理答案均给分) (各1分,共2分)
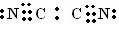 (2) (2分)
(2) (2分)
(3)Na3N + 4HCl = 3NaCl+NH4Cl(2分)
(4)① C2H6(g)+7/2 O2(g) = 2CO2 (g) + 3H2O (l) ;△H = 一1559 kJ / mol(2分)
或 2C2H6(g)+7 O2(g) = 4CO2 (g) + 6H2O (l) ;△H = 一3118 kJ / mol
② 2 Fe2+ + 6 I- + 4 H2O2 + 8 H+ = 2 Fe3+ + 3 I2 + 8 H2O(3分)
11.A、B、C、D、E均为短周期元素,且原子序数依次递增。A、E同主族,B、D同周期,且B和D最外层电子数之和为10;A与D可形成,A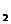 D、A
D、A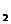 D
D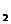 共价化合物。请回答下列问题。
共价化合物。请回答下列问题。
(1)D位于周期表第_______周期,_________族;
(2)E离子的结构示意图为_________________;与E同周期的元素中,金属性最弱的金属元素名称是_________,最稳定的气态氢化物的化学式为_________;
(3)C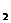 的电子式为______,B与D通常能形成______晶体,在E
的电子式为______,B与D通常能形成______晶体,在E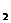 D
D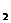 中含有的化学键有_;
中含有的化学键有_;
(4)由A、B、C、D四种元素组成的离子化合物的化学式为(写出一种即可)_______________,组成的共价化合物的结构简式为(写出一种即可)___________________;
[答案]
(1)2
ⅣA 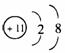
(2)铝 HCl
(3)  分子 离子键、非极性键(或共价键)
分子 离子键、非极性键(或共价键)
(4)NH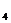 HCO
HCO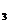 [或(NH
[或(NH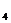 )
)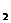 CO
CO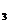 ] NH
] NH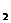 -CH
-CH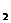 -COOH(或尿素、其他氨基酸等)
-COOH(或尿素、其他氨基酸等)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com