
17.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 ( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
16.化学中常用类比的方法可预测许多物质的性质。如根据H2+Cl2=2HCl推测:H2+Br2=2HBr。
|
|
A.由Fe+S====FeS 推测:Fe+Cl2====FeCl2
B.由2CO2+Ca(ClO)2+2H2O=Ca(HCO3)2+2HClO,
推测:CO2+NaClO+H2O=NaHCO3+HClO
C.由CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,
推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D.由Na2SO3+2HCl=2NaCl+H2O+SO2↑,
推测:Na2SO3+2HNO3=2NaNO3+H2O+SO2↑
15.300 mL 2 mol/L硝酸与一定量的铝镁铁合金反应生成3.36 L NO(标准状况)和铁盐、铝盐、镁盐等,再向反应后的溶液中加入3 mol/L的NaOH溶液,使铝镁铁元素恰好全部转化为沉淀,则所加NaOH溶液的体积是 ( )
A.150mL B.200mL C.450mL D.无法计算
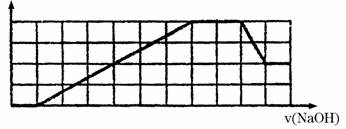
14.某无色溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图象如下所示,下列说法正确的是 ( )
A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B.原溶液中一定含有SO42-和Na+
C.原溶液中含有的Fe3+和A13+的物质的量之比为1∶1
D.反应最后形成的溶液中含有的溶质为Na2SO4
13.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是 ( )
A.X的原子序数比Y的小
B.X原子的最外层电子数比Y的大
C.X的原子半径比Y的大
D.X元素的最高正价比Y的小
12.已知,Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是 ( )
A.FeS、Al(OH)3和S B.Fe(OH)3和Al(OH)3
C.Fe2S3和Al(OH)3 D.Al2S3、FeS和S
11.在稀硫酸中加入铜粉,铜粉不溶,再加入下列固体粉末:①FeCl2;②Fe2O3;③Zn;④KNO3;⑤HCl;⑥H2O2;铜粉可溶解的是 ( )
A.①②⑤ B.②④⑥ C.②③⑤ D.①④⑥
10.某同学在实验报告中写有以下实验数据:①用托盘天平称取11.7g食盐;②用量筒量取5.26mL的盐酸;③用广泛pH试纸测得某酸溶液的pH值是3.3;④滴定盐酸时用去23.00mLNaOH溶液,其中数据合理的是 ( )
A.①② B.③④ C.①④ D.①③④
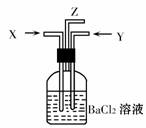
9.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体
Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),
下列有关说法正确的是 ( )
A.洗气瓶中产生的沉淀中有碳酸钡
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.洗气瓶中无沉淀产生
8.下列反应的离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入过量的NaOH溶液:
Ca2++HCO3-+OH-====CaCO3↓+H2O
B.溶液中NH4HSO4与NaOH等物质的量混合:
NH4++HSO4-+2OH-====SO42-+NH3·H2O+H2O
C.过量的CO2通入Na[Al(OH)4]溶液中:
CO2+[Al(OH)4]-====Al(OH)3↓+HCO3-
 D.硫化钠溶于水中:S2-+H2O====HS-+OH-
D.硫化钠溶于水中:S2-+H2O====HS-+OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com