
8. 下列叙述正确的是 ( )
A. 元素的单质一定由氧化或还原该元素的化合物制得
B. 含有最高价元素的化合物不一定具有很强的氧化性
C. 阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D. 在化学反应中,得电子越多的氧化剂,其氧化性就越强
[答案]B
7. ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A.1:1 B.2:1
C.1:2 D.2:3
[答案]B
6. 工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
⑴4FeO·Cr2O3+8Na2CO3+7O2 
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
⑵2Na2CrO4+H2SO4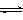 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法中正确的是 ( )
A.反应⑴和⑵均为氧化还原反应
B.反应⑴的氧化剂是O2,还原剂是FeO·Cr2O3
C.高温下,O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时共转移7mol电子
[答案]B
5. C1SO3H称为氯磺酸,是一种强酸。对于反应:
ClSO3H+HCOOH=CO+HCl+H2SO4有如下判断,其中较合理的是 ( )
A.此反应属于氧化还原反应 B.此反应不属于氧化还原反应
C.反应后溶液的pH值变小 D.反应后溶液的pH值增大
[答案]BC
4. ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:
2KClO3+H2C2O4+H2SO4
 2ClO2↑+K2SO4+2CO2↑+2H2O
2ClO2↑+K2SO4+2CO2↑+2H2O
下列说法不正确的是 ( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2做水处理剂时,利用了其强氧化性
[答案]C
3. 下列化学方程式中电子转移不正确的是 ( )
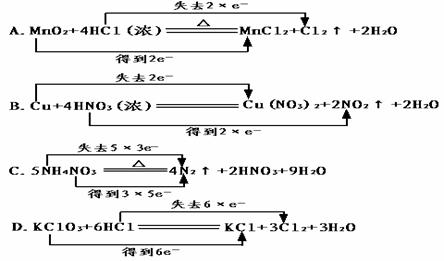
[答案]D
2. 氮化铝(AlN)广泛应用于电子,陶瓷等工业领域,在一定的条件下,AlN可通过反应
 Al2O3+N2+3C 2
AlN+3CO合成,下列叙述正确的是
( )
Al2O3+N2+3C 2
AlN+3CO合成,下列叙述正确的是
( )
A.上述反应中,N2是还原剂,Al2O3是氧化剂;
B.上述反应中,每生成1mol AlN,需转移3 mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
[答案]B
1. 下列物质转化需要加入还原剂才能实现的是 ( )
A.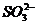 →SO2 B.HCl→Cl2 C.Na→Na+ D.SO2→S
→SO2 B.HCl→Cl2 C.Na→Na+ D.SO2→S
[答案]D
14. 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
(2)上述冶炼过程中产生大量SO2。下列处理方案合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应的催化过程。 、 (不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。证明炉渣中含有的实验现象为
。
答案:
(1)Cu、O
(2)b、c
(3)2Fe3++2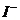 =2Fe2++I2
=2Fe2++I2 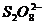 +2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
+2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分)
(4)a:稀硫酸、KMnO4溶液
b:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色
[解析]:(1)若CuFeS2中Fe的化合价为+2,则Cu化合价为+2,S化合价为-2,分析化学方程式两边元素化合价的变化可知,化合价降低的元素被还原,有Cu和O元素。关于SO2的吸收问题,一是不能高空排放,因为这样做,没有从根本上解决污染问题;二是不能用浓硫酸吸收,因SO2难溶于浓硫酸。只有变废为宝,才能符合“绿色化学”的概念,答案选b、c.
(2)此题要从催化剂的本质出发,作为催化剂的物质要参与有关反应,但后来的反应必须又生成了催化剂。本题要求写出表示Fe3+作催化剂的反应,因此,首先Fe3+要参与反应,即有反应2Fe3++2I-=2Fe2+ +I2,生成的Fe2+又被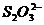 -氧化生成了Fe3+。此题若要求写出Fe2+对上述反应的作催化剂的话,就应写成如下方程式:
-氧化生成了Fe3+。此题若要求写出Fe2+对上述反应的作催化剂的话,就应写成如下方程式: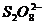 +Fe2+=2
+Fe2+=2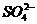 +2Fe3+,2Fe3++2I-=2Fe2+ +I2,虽是二个相同反应方程式,由于二者的前后顺序的颠倒,却产生了本质的区别
+2Fe3+,2Fe3++2I-=2Fe2+ +I2,虽是二个相同反应方程式,由于二者的前后顺序的颠倒,却产生了本质的区别
(3)此题考查是混合物的分离与提纯及常见离子的鉴别。因Al2O3溶于酸后生成了Al3+,Al3+又能与过量NaOH的反应生成可溶性的钠盐(NaAlO2),然后将溶液中的难溶物Fe(OH)3沉淀过滤出来,将沉淀洗涤、干燥、煅烧得Fe2O3。故除去Al3+的离子方程式是Al3++4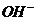 =
=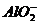 +2H2O。要证明炉渣中含有FeO的方法,最好利用Fe2+的还原性,先将混合物溶于过量的稀硫酸中(FeO→Fe2+),然后滴入KMn04溶液,观察其溶液是否褪色。注意所用酸不能是硝酸或盐酸,因硝酸会将Fe2+氧化成Fe3+;盐酸会还原KMnO4溶液而使之褪色,干扰了Fe2+的检验
+2H2O。要证明炉渣中含有FeO的方法,最好利用Fe2+的还原性,先将混合物溶于过量的稀硫酸中(FeO→Fe2+),然后滴入KMn04溶液,观察其溶液是否褪色。注意所用酸不能是硝酸或盐酸,因硝酸会将Fe2+氧化成Fe3+;盐酸会还原KMnO4溶液而使之褪色,干扰了Fe2+的检验
[考点分析]氧化还原反应综合应用
[专题突破]
13. 含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
[答案]B
[解析]由于Fe2+的还原性强于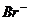 ,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2,然后再氧化
,故根据氧化还原反应的先后顺序知,Cl2先氧化Fe2,然后再氧化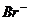 。2Fe2+ + Cl2
。2Fe2+ + Cl2  2Fe3+ + 2
2Fe3+ + 2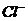 ,2
,2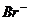 + Cl2
+ Cl2  Br2 + 2
Br2 + 2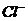 ,2FeBr2 + 3Cl2
,2FeBr2 + 3Cl2  2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确
2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确
当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;
当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
[考点分析]氧化性强弱比较氧化还原反应的相关计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com