
4、沉淀溶解平衡的特征:
3、沉淀溶解平衡方程式的书写:如Ca(OH)2(S)
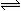 Ca2+ + 2OH- AgCl(S)
Ca2+ + 2OH- AgCl(S) 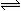 Ag+ + Cl-
Ag+ + Cl-
2、沉淀溶解平衡:一定温度下,当沉淀溶解速率和沉淀生成速率相等时,形成饱和溶液,达到的平衡状态。
1、物质的溶解度:固体: 气体:
6、 三大守恒问题: 电荷守恒:
三大守恒问题: 电荷守恒:
物质料守恒:
水电离出的H+和OH-的1:1守恒:
5、 盐类水解规律的应用: 判断离子浓度的相对大小:
盐类水解规律的应用: 判断离子浓度的相对大小:
制备盐的晶体:
配制盐的溶液:
判断对应酸或碱的相对强弱:
酸碱中和滴定时指示剂的选择:
某些盐溶液的分离与提纯:
日常生活中应用:泡沫灭火器、明矾净水、化肥施用、草木灰去油污等。
4、 盐类水解的影响因素: 温度:
盐类水解的影响因素: 温度:
浓度:
酸或碱:
加弱离子:
3、盐类水解的离子方程式:CH3COONa NH4Cl
Na2CO3 AlCl3 CH3COONH4
AlCl3+Na2S AlCl3+NaAlO2 AlCl3+NaHCO3
思考:写出NaHCO3溶液中存在的三个平衡:________________________________________________
2、盐类水解的规律:_________________________________________________________________________。
1、盐类水解的实质:盐电离出的“弱离子”与水电离出的H+或OH‑离子反应生成弱电解质的过程,从而促进了水的电离。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com