
9.停杯投箸不能食,拔剑四顾心茫然。
长风破浪会有时,直挂云帆济沧海。(以上出自李白《行路
难》)
8.我寄愁心与明月,随君直到夜郎西。(李白《闻昌龄左迁龙
标遥有此寄》)
7.大漠孤烟直,长河落日圆。(王维《使至塞上》)
6.潮平两岸阔,风正一帆悬。海日生残夜,江春入旧年。(王
湾《次北固山下》)
5.海内存知己。天涯若比邻。(王勃《送杜少府之任蜀州》)
4.采菊东蓠下,悠然见南山。
此中有真意,欲辨已忘言。(以上出自陶渊明《饮酒》)
3.树木丛生,百草丰茂。秋风萧瑟,洪波涌起。日月之行,若出
其中;星汉灿烂,若出其里。(曹操《观沧海》)
2.溯洄从之,道阻且长,溯游从之,宛在水中央。(《蒹葭》)
1.窈窕淑女.君子好逑。(《关睢》)
(二)SO32-的检验
向溶液中加入盐酸,将产生的气体通入品红溶液中红色褪去;或加入氯化钡溶液生成白色沉淀,加入盐酸,沉淀溶解并产生具有刺激性气味的气体。发生的反应为(写离子方程式):SO32-+2H+=SO2↑+H2O;SO32-+Ba2+=BaSO3↓,BaSO3+2H+=Ba2++SO2↑+H2O。
[基础训练]
1、有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀。对此实验下列叙述正确的是( D )
A、Na2SO3已部分被空气中的氧气氧化
B、加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4
C、加硝酸后的不溶沉淀是BaSO4和BaSO3的混合物
D、此实验不能确定Na2SO3是否部分被氧化
2、检验某溶液中是否含有SO42-时,为了防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( A )
A、先加稀盐酸将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀
B、先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀
C、向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀
D、向溶液中滴加稀HNO3酸化的BaCl2溶液,看是否生成白色沉淀
3、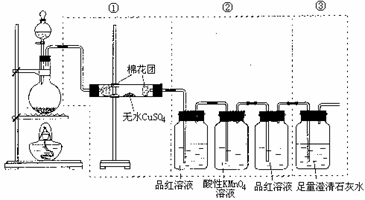 下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。
下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是SO2,CO2;不能检出的物质是H2O。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是H2O;不能检出的物质是SO2,CO2。
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是SO2,CO2;不能检出的物质是H2O。
[高考模拟]
4、(2007海南化学)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmolH2SO4、ymolAgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( A )
A、(y-2x)/a B、(y-x)/a C、(2y-2x)/a D、(2y-4x)/a
5、 (2008天津理综28)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(2008天津理综28)实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%-30%的稀硫酸溶液,在50℃-80℃水浴中加热至不再产生气泡。将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式:Fe+H2SO4 FeSO4+H2↑。
(2)硫酸溶液过稀会导致反应速率慢,不利于晶体析出。
(3)采用水浴加热的原因是容易控制温度。
(4)反应时铁屑过量的目的是(用离子方程式表示)Fe+2Fe3+=3Fe2+。
(5)溶液趁热过滤的原因是减小FeSO4的损失。
塞紧试管口的目的是防止空气进入试管将Fe2+氧化为Fe3+。
(6)静置冷却一段时间后,在试管中观察到的现象是有浅绿色晶体析出。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com