
11. 在一密闭容器中有如下反应:L (s) + a G (g)
在一密闭容器中有如下反应:L (s) + a G (g)  b R (g)
b R (g)
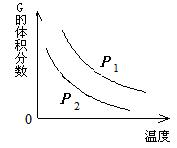
温度和压强对该反应的影响如右图所示,其中压强P1 < P2,
由此可判断 ( )
A. 正反应为放热反应
B. 化学方程式中的计量数a > b
C. G的转化率随温度升高而减小
D. 增大压强,容器内气体质量不变
10..定温度、压强和有铁触媒的条件下,在密闭容器中充入N2、H2和NH3 。若起始时n(N2)=x mol、n(H2)=y mol、n(NH3)=z mol (x、y、z均不为0 ),平衡时,n(N2)=0.1mol、n(H2)=0.3mol、n(NH3)=0.08mol。下列有关判断不合理的是 ( )
A.x : y =1 : 3
B.N2、H2的转化率不相等
C.平衡时,H2与NH3的生成速率之比为3 : 2
D.x的取值范围为0<x<0.14
9.有下列三个反应:①Cl2 + FeI2 = FeCl2 + I2 ②2Fe2+ + Br2 = 2Fe3+ + 2Br-
③Co2O3 + 6HCl = 2CoCl2 + Cl2↑+ 3H2O ,下列说法正确的是 ( )
A.①②③中的氧化产物分别是FeCl2 、Fe3+、Cl2
B.根据以上方程式可以得到氧化性Cl2 > Co2O3 > Fe3+
C.在反应③中生成1mol Cl2时,有2molHCl被氧化
D.根据反应①②一定可以推理得到Cl2 + FeBr2 = FeCl2 +Br2
8. 不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和蒸汽,其燃料为 ,电解质为熔融的
,电解质为熔融的 ,工作温度为600℃~700℃。已知该电池的总反应为
,工作温度为600℃~700℃。已知该电池的总反应为 ;负极反应为
;负极反应为 ,则下列推断正确的是 ( )
,则下列推断正确的是 ( )
A.正极反应为:4OH- === O2+4e-+2H2O
B.放电时 向正极移动
向正极移动
C.电池供应1mol水蒸气,转移的电子数为4mol
D.正极反应为:O2+4e-+2CO2 ===2CO32-
7.反应2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O,下列说法正确的是 ( )
A.H2CrO4是氧化剂,H2O是氧化产物 B.若3mol H2O2完全反应,则反应中共转移了6NA个电子 C.还原剂与氧化剂的质量比是1:2[M(H2CrO4)=118,M(H2O2)=34] D.氧化产物和还原产物的物质的量之比为2:3
6.根据下列热化学方程式
(1)C(s) + O2(g) = CO2(g) △H1=–393.5 kJ/mol
(2)H2(g) +  O2(g) =H2O(l) △H2=–285.8 kJ/mol
O2(g) =H2O(l) △H2=–285.8 kJ/mol
(3)CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3kJ/mol
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为 ( )
A.△H =+244.1kJ/mol B.△H =-488.3kJ/mol
C.△H =-996.6kJ/mol D.△H =+996.6kJ/mol kJ/mol
5.镁--H2O2酸性电池采用海水作电解质(加入一定量酸),下列说法正确的是( )
A.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O
B.负极反应为H2O2+2e-+ 2H+= 2H2O
C.电池工作时,正极周围海水的pH减小
D.电池工作时,溶液中的H+向负极移动
4.在一定条件下的密闭容器中存在下列四个平衡体系,增大容器的体积对化学反应速率没有影响的是 ( )
A.2SO2 + O2 2SO3 B.CO +H2O(g)
2SO3 B.CO +H2O(g) CO2 + H2
CO2 + H2
C.CO2(g)+H2O H2CO3 D.Fe3++SCN-
H2CO3 D.Fe3++SCN-  Fe(SCN)3
Fe(SCN)3
3.下列有关工业生产的叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可提高N2、H2的转化率
B.硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂,
C.电解饱和食盐水制烧碱采用离子交换膜法,可防阴极室产生的C12进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量和阴极析出铜的质量相同
2.下列叙述正确的是 ( )
A.粗铜精炼时,把粗铜接在电源的负极
B.充电时,把铅蓄电池的负极接在外电源的正极
C.镀锡铁破损后铁更易被腐蚀
D.碱性氢氧燃料电池工作时,负极反应为:


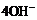
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com