
2. 反应A+3B==2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol·L-1·s-1; ②v(B)=0.6mol·L-1·s-1;③v(C)=0.4 mol·L-1·s-1;④v(D)=0.45 mol·L-1·s-1。 该反应进行的快慢顺序为 。
[答案]④>③=②>①
[解析]以一种物质作为参照物进行比较
[考点分析]化学反应速率快慢比较
1. 将 4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol•L-1 ,现有下列几种说法:
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol•L-1 ,现有下列几种说法:
①用物质 A 表示的反应的平均速率为 0.3 mol•L-1•s-1
②用物质 B 表示的反应的平均速率为 0.6 mol•L-1•s-1
③2 s 时物质 A 的转化率为70%
④2 s 时物质 B 的浓度为 0.7 mol•L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
[答案]B
[解析]本题考查物质的量浓度的表示法,用不同反应物或生成物表示反应速率的方法和反应中转换率的计算等知识,考查内容的知识容量较大。
V(C)=0.6mol/2L×2s=0.3 mol·L-1·s-1所以,V(A)=0.3 mol·L-1·s-1 V(B)=0.15 mol·L-1·s-1
A的转换率为0.6mol/L×2L/4mol×100%=30%。
2s时B的浓度为2mol/2- V(B)×2s=0.7mol/L。只有①、④ 所以B正确
[考点分析]化学反应速率概念的计算
5. 等效平衡
(1)恒温恒容条件下的等效平衡
 在恒温、恒容的情况下,对于同一可逆反应,不论各反应物的起始量是多少,也不管反应物是一次加入或分几次加入,或是加入后分一次取出或分几次取出,只要各物质的起始量(质量、物质的量、浓度、体积等)按化学计量数换算成方程式左右两边同一边后对应相同,则就可以达到等效平衡
在恒温、恒容的情况下,对于同一可逆反应,不论各反应物的起始量是多少,也不管反应物是一次加入或分几次加入,或是加入后分一次取出或分几次取出,只要各物质的起始量(质量、物质的量、浓度、体积等)按化学计量数换算成方程式左右两边同一边后对应相同,则就可以达到等效平衡
这种情况下建立的等效平衡,不但平衡混合物中各组分的质量分数(物质的量分数、体积分数)对应相等,而且各组分的质量、体积、物质的量、浓度等也分别对应相等。
(2)恒温恒压条件下的等效平衡
 在恒温恒压的情况下,对于有气体物质参加的可逆反应,改变反应物的起始状态,只要各起始反应物之间的物质的量之比按化学计量数换算成化学方程式左右两边同一边后对应相等,即可达到等效平衡
在恒温恒压的情况下,对于有气体物质参加的可逆反应,改变反应物的起始状态,只要各起始反应物之间的物质的量之比按化学计量数换算成化学方程式左右两边同一边后对应相等,即可达到等效平衡
在这种情况下建立的等效平衡,平衡混合物中各成份的质量、体积、物质的量、浓度并不一定相等
(3)特例
在恒温恒容的情况下,对于反应前后气体分子数不变的可逆反应,其实在到达平衡的过程中压强也一直保持不变,因此只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
[典例精析]
5. 判断转化率大小变化
(1)增大某一反应物浓度可使其它反应物转化率增大,而自身下降。降低它的浓度依然。
(2)恒容容器中增大某一反应物浓度可使其它反应物浓度减小生成物浓度增大,化学平衡向正向移动;降低某一反应物浓度可使其它反应物浓度增大生成物浓度减小,化学平衡移动向逆向移动。改变生成物浓度与上述情况类似
因此,转化率的变化可能是化学平衡向正向移动的结果,也可能是化学平衡向逆向移动的结果。
4.解答图象题的方法与思路是:
⑴看懂图象:一看面(即看清横坐标和纵坐标),二看线(即看线的走向、变化的趋势),三看点(即看线是否通过原点,两条线的交点及线的拐点),四看要不要作辅助线(如等温线、等压线),五看定量图象中有关量的多少
⑵联想规律:即联想外界条件对化学反应速率即化学平衡影响规律、且熟练准确。
⑶作出判断:依题意仔细分析作出正确判断
3. 影响化学平衡常数的因素:
(1)化学平衡常数只与温度有关,升高或降低温度对平衡常数的影响取决于相应化学反应的热效应情况;反应物和生成物的浓度对平衡常数没有影响。
(2)反应物和生成物中只有固体和纯液体存在时,由于其浓度可看作“1”而不代入公式。
(3)化学平衡常数是指某一具体反应的平衡常数。若改变反应方向,则平衡常数改变;
若方程式中的化学计量系数等倍扩大或缩小,尽管是同一反应,平衡常数也会发生改变。
2. 化学平衡常数的理解
平衡常数的数学表达式及单位:
 如对于达到平衡的一般可逆反应:aA
+ bB
如对于达到平衡的一般可逆反应:aA
+ bB 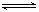 pC + qD反应物和生成物平衡浓度表示为C(A)
、C
(B)、C(C)
、C(D)
pC + qD反应物和生成物平衡浓度表示为C(A)
、C
(B)、C(C)
、C(D)
 化学平衡常数:Kc=
cp(C)·cq(D)/ca(A)·cb(B)。
化学平衡常数:Kc=
cp(C)·cq(D)/ca(A)·cb(B)。
K的单位为(mol·L-1)Dn
1、理解平衡移动原理:
(1)“减弱”的双重含义
定性角度:平衡移动的方向为减弱外界改变的方向
定量角度:移动的结果只是减弱了外界条件的变化,而不能完全抵消外界条件的变化量
(2)分清“三个变化量”:
A.条件改变时的量变
B.平衡移动过程中的量变
C.原平衡与新平衡的量变。
(3)适应其他体系。
(4)不能用勒沙特列原理解释:
A. 催化剂的使用
B. ΔV(g)=0的可逆反应
C.外界条件的改变对平衡的影响与生产要求不完全一致(如合成氨温度选用)
17、(13分)如图所示,ABCDO是处于竖直平面内的光滑轨道,AB是半径为R=15m的 圆周轨道,CDO是直径为15m的半圆轨道。AB轨道和CDO轨道通过极短的水平轨道(长度忽略不计)平滑连接。半径OA处于水平位置,直径OC处于竖直位置。一个小球P从A点的正上方高H处自由落下,从A点进
圆周轨道,CDO是直径为15m的半圆轨道。AB轨道和CDO轨道通过极短的水平轨道(长度忽略不计)平滑连接。半径OA处于水平位置,直径OC处于竖直位置。一个小球P从A点的正上方高H处自由落下,从A点进 入竖直平面内的轨道运动(小球经过A点时无机械能损失)。当小球通过CDO轨道最低点C时对轨道的压力等于其重力的
入竖直平面内的轨道运动(小球经过A点时无机械能损失)。当小球通过CDO轨道最低点C时对轨道的压力等于其重力的 倍,取g为10m/s2。
倍,取g为10m/s2。
(1)试求高度H的大小;
 (2)试讨论此球能否到达CDO轨道的最高点O,并说明理由;
(2)试讨论此球能否到达CDO轨道的最高点O,并说明理由;
(3)求小球沿轨道运动后再次落回轨道上时的速度大小。
16、(10分)在月球上以初速度v0自高h处水平抛出的小球,射程可达x,已知月球半径为R,如果在月球上发射一颗月球的卫星,求它在月球表面附近环绕月球运动的周期是多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com