
8. 在一定条件下,将3 molA和1
molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应: 。
2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L
。
2 min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol·L 下列判断正确的是( )
下列判断正确的是( )
A.平衡常数约为0.3
B.B的转化率为60%
C.A的平均反应速率为0.3mol·(L·min)

D.若混合气体的密度不变则表明该反应达到平衡状态
7. 对于反应2A(g)+B(g)
对于反应2A(g)+B(g)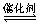 2C(g),△H =- a kJ/mol ,(a>0)下列判断正确的是
2C(g),△H =- a kJ/mol ,(a>0)下列判断正确的是
A.2体积A和足量B反应,必定生成2体积C,放出a KJ热量
B.若反应容器的容积和温度不变,增大压强,平衡必定向右移动
C.平衡时,A消耗速度必定等于B生成速度的两倍
 D.平衡时,A浓度必定等于B浓度的两倍
D.平衡时,A浓度必定等于B浓度的两倍
6.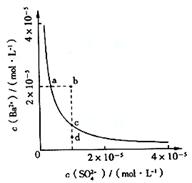 高温下,某反应达平衡,平街常数
高温下,某反应达平衡,平街常数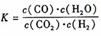 恒容时,温度升高.H2浓度减小。下列说法正确的是
恒容时,温度升高.H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为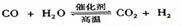
5. 某可逆反应 ,若按下列两种配比
,若按下列两种配比
(1)0.8molA 1.2molB 1.2molC 2.4molD
(2)1.4molA 2.1molB 0.6molC 1.2molD
将它们放入一容积不变的密闭容器中,保持温度不变,达平衡后C的质量分数仍相等,则化学反应方程式中x的值为( )
A、2 B、3 C、4 D、1
4. 在一定温度下,将CO和水蒸汽各1mol放在密闭容器中反应:
 ,达平衡后测得
,达平衡后测得 为0.6mol,再通入4mol水蒸汽,达新的平衡后,
为0.6mol,再通入4mol水蒸汽,达新的平衡后, 物质的量( )
物质的量( )
A等于0.6mol B等于1mol
C大于0.6mol,小于1mol D大于1mol
3.
 和
和 充入一容积不变的密闭容器中,在一定条件下反应
充入一容积不变的密闭容器中,在一定条件下反应 (气)达平衡时,
(气)达平衡时, 为0.4mol,此时若移走
为0.4mol,此时若移走 和
和 在相同温度下达平衡时
在相同温度下达平衡时 的物质的量是( )
的物质的量是( )
A 0.4mol B0.2mol
C小于0.2mol D大于0.2mol而小于0.4mol
2. 将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol,用反应物浓度的减少来表示该反应的速率可能为( )
将气体A、B置于容积为2L的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4s末,测得A为0.5mol,B为0.4mol,C为0.2mol,用反应物浓度的减少来表示该反应的速率可能为( )
A
B
C
D
1. 已知 若反应速率分别用
若反应速率分别用 、
、
 表示,则正确的关系是( )
表示,则正确的关系是( )


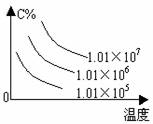
3. 转化率-温度-压强关系图:
转化率-温度-压强关系图:
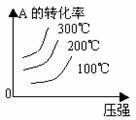
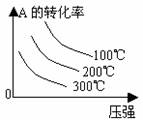
m+n>p+q 时,△H 0 m+n<p+q 时,△H 0 4.含量-温度-压强关系图:
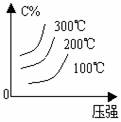
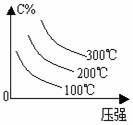
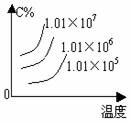
m+n>p+q 时,△H 0 m+n<p+q 时,△H 0 m+n>p+q 时,△H 0 m+n>p+q 时,△H 0
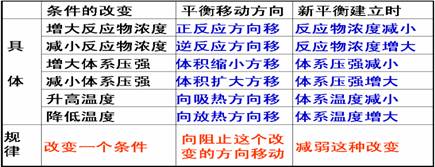
勒夏特列原理
6、 了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。
[教法指引]
本专题是基本理论部分难度较大的一个专题,教师在复习此专题时,应加强如下知识点的教学:
①考查反应速率的简单计算。
②各物质间反应速率的关系;化学反应速率的大小比较。
③根据浓度、温度、压强、催化剂、颗粒大小等外界因素定性判断反应速率的变化。
④ v-t图象的分析,会用反应速率知识解决实际问题,对图象的变化能作出合理的解释。
⑤可逆反应的特点;化学平衡的建立、特征、及标志。
⑥化学平衡与化学反应速率之间的内在联系。
⑦等效平衡。
⑧外界条件对化学平衡的影响。
 ⑨理解化学平衡和化学平衡常数的含义,能用化学平衡常数计算反应物的转化率。
⑨理解化学平衡和化学平衡常数的含义,能用化学平衡常数计算反应物的转化率。
以上几点都是高考中的重要知识点,我们在教学过程中不能急于求成,要结合学生掌握的情况,及时总结,查漏补缺。对一些薄弱环节还应强化训练,但不能忽略基础知识的再巩固
[知识网络]
化学反应速率


化学平衡



 化学平衡图像的常见类型:
化学平衡图像的常见类型: 对于反应mA(g)+nB(g)
对于反应mA(g)+nB(g) pC(g)+qD(g) △H
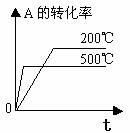
1.转化率-时间关系图:
pC(g)+qD(g) △H
1.转化率-时间关系图:
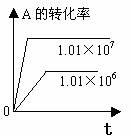
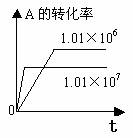
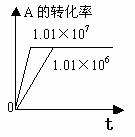
P一定时,△H
0 T一定时,m+n p+q T一定时,m+n p+q T一定时,m+n p+q
2.含量-时间关系图:
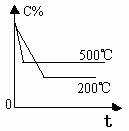
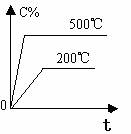
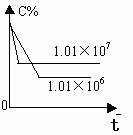
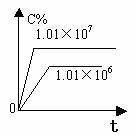 P一定时,△H 0 P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q
P一定时,△H 0 P一定时,△H 0 T一定时,m+n p+q T一定时,m+n p+q
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com