
7. 下列各组离子在指定条件下,一定能大量共存的是
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl-
C.水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、Cl-、NO3-
D.能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3-
6. 亚硝酸盐中毒,又名乌嘴病、紫绀病、肠源性青紫病。亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象。美蓝是亚硝酸盐中毒的有效解毒剂。下列说法不正确的是
A. 在中毒过程中血红蛋白被还原 B. 中毒时亚硝酸盐发生还原反应
C. 药品美蓝应具有还原性 D. 解毒时高铁血红蛋白被还原
5. 在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
A.Al2S3和I2 B.FeS、Al(OH)3和S C.Fe2S3和I2 D.Fe(OH)3和Al(OH)3
4. 用NA表示阿伏加德罗常数的值。下列叙述正确的是
A. 常温常压下,20 g D2O和足量的金属钠反应产生气体的分子数为0.5NA
B. 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
C. 标准状况下,2.24L苯中约含有3.612×1023个碳原子
D. 常温常压下,1 mol甲基(-CH3)所含的电子数为10NA
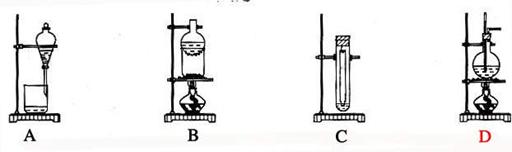
3. 下列实验装置不适用于物质分离的是
2. 下列有关化学用语使用正确的是
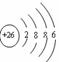 A.Fe2+的离子结构示意图:
B.NH4Cl的电子式:
A.Fe2+的离子结构示意图:
B.NH4Cl的电子式: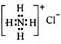
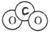
C.原子核内有10个中子的氧原子: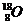 D.CO2的分子模型示意图:
D.CO2的分子模型示意图:
1. 2009年度江苏省级节能减排(节能与循环经济)专项引导资金实施公交车“油改气”工程。公交车印有“CNG”标志(CNG汽车是指以压缩天然气替代常规汽油或柴油作为汽车燃料的汽车)。城市推行这一改革的主要目的是
A.延长发动机的寿命 B.促进地方经济的发展,增加再就业机会
C.节约能源 D.减少大气污染
2、本章内容自我小结。
[板书设计]略。
[后记]
3、 反应有许多重要的应用。
⑴在实验室里和工业上各是利用什么化学反应来制备氯气的?你还能举出实验室里和工业上利用化学反应制备物质的实例吗?
可以利用氧化还原反应的原理,设计能够产生0价的氯单质的化学反应。
⑵怎样证明化学能与热能、电能或光能之间能发生相互转化?
利用化学反应中温度的变化,电流计和光敏计的测定等方法。
⑶根据你对化学反应的规律、实质及应用的认识,进一步丰富以上有关化学反应的图示。
如:总结中使用的图示,可以再丰富。
[点评]通过两课时的探究,使学生认识到化学反应在人类活动中的重要作用及其价值。
[练习]本节练习1、2。
[作业、预习]1、本节教材习题4、5。
1、面临纷繁复杂的化学反应,为了研究和应用的方便,人们从不同的角度进行了分类。
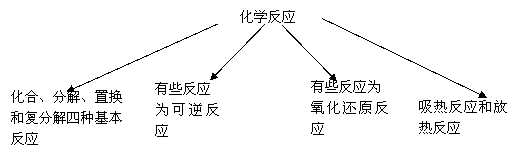
举例说明以上对于化学反应的划分原则。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com