
6.实行集体林权制度改革,是在保持林地集体所有制不变的前提下,把林地的使用权、林木的所有权、经营权、处置权和收益权交给农民。集体林权制度改革中保持林地集体所有制不变
① 是实现共同富裕的要求 ②是坚持社会主义基本经济制度的要求 ③有利于发挥公有制的主体作用 ④有利于增强国有经济的控制力
是实现共同富裕的要求 ②是坚持社会主义基本经济制度的要求 ③有利于发挥公有制的主体作用 ④有利于增强国有经济的控制力
A.①②③ B.②③④ C.①②④ D.①③④
下表为某县近年经济增长与恩格尔系数一览表,回答4-5题。
|
年 份 |
2004 |
2005 |
2006 |
2007 |
2008 |
|
国民生产总值比上年增长 |
7.3% |
8% |
9.1% |
9.5% |
8.1% |
|
城镇居民恩格尔系数(%) |
37.2 |
36.7 |
36.1 |
36.7 |
35.7 |
|
农村居民恩格尔系数(%) |
44.7 |
43.2 |
42.6 |
43.2 |
42.5 |
注:2007年,该县城乡居民收入均有较大增长,其中,城市居民比农村居民收入增长高出16.5%。
3.解读上表,正确的结论是
A.经济增长与恩格尔系数的降低不完全一致
B.经济增长与恩格尔系数的降低无必然联系
C.城镇居民食物消费在消费总支出中的比重高
D.农村居民食物消费的总量高于城镇居民
4.根据上表,造成该县2007年我国恩格尔系数回升的因素可能是
A.国民生产总值快速增长 B.居民人均纯收入减少
C.国家出现物价上涨 D.国家出现通货紧缩
5..国内电影娱乐巨头华谊兄弟传媒股份有限公司10月30日在创业板市场正式上市,这意味着华谊成为内地第一家上市娱乐公司。以下体现股份有限公司所具有的特点有
①公司以固定资产对自己的债务承担责任 ②公司的全部资本划分为等额股份
③股东可以要求股份公司返还其出资 ④股东对公司承担有限责任
A.①② B.②③ C.①④ D.②④
目前,以福建、江西、辽宁、浙江等试点省区为先导的集体林权制度改革正在全国集体林区轰轰烈烈地展开。“山定权,树定根,人定心”,带来了我国农村生产力的又一次大解放。
2.2009年10月1日至8日连放8天,这个国庆中秋假期被不少人称作“史上最长时间黄金周”。市民出游热情空前高涨,周边游红火,长途游受宠,红色旅游成为今年黄金周的亮点。发展红色旅游可以
①增加老区人民的收入 ②促进资源的优化配置
③解决全社会就业问题 ④推动和扩大市场消费
A.②③④ B.①②③ C.①②④ D.①③④
1. 右图描述的是某商品的价格走势,下
右图描述的是某商品的价格走势,下
列对该图理解错误的是
A.生产企业要努力降低该商品生产成本
B.生产者可能会缩小该商品的生产规模
C.该商品的互补商品需求量会有所增加
D.该商品的替代商品需求量会有所增加
4.解答化学平衡问题的重要思维方法
(1)可逆反应“不为零”原则
可逆性是化学平衡的前提,达到平衡时应是反应物和生成物共存的状态,每种物质的物质的量不为零。
一般可用极限分析法推断:假设反应不可逆,则最多生成产物多少,有无反应物剩余,余多少。这样的极值点是不可能达到的,故可用确定某些范围或在范围中选择合适的量。
(2)“一边倒”原则
可逆反应,在条件相同时(等温等容),若达到等同平衡,其初始状态必须能互变,从极限角度看,就是各物质的物质的量要相当。因此,可以采用“一边倒”的原则来处理以下问题:化学平衡等同条件(等温等容)
aA(g)+bB(g) cC(g)
cC(g)
①始 a b 0 平衡态Ⅰ
②始 0 0 c 平衡态Ⅱ
③始 x y z 平衡态Ⅲ
为了使平衡Ⅲ=Ⅱ=Ⅰ
根据“一边倒”原则,即可得


(3)“过渡态”方法
思路:各种反应物的浓度增加相同倍数,相当于增大体系压强,根据平衡移动方向来确定转化率的变化情况。
考题名师诠释
[例1] 将4 mol A气体和 2 mol B 气体在2 L容器中混合,并在一定条件下发生如下反应:
2A(g)+B(g) 2C(g)
2C(g)
若经2 s后测得C的浓度为0.6 mol·L-1,现有下列几种说法,其中正确的是( )
①用物质A表示的反应的平均速率为0.3 mol·L-1·S-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·S-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
A.①③ B.①④ C.②③ D.③④
解析:由题知2 s时C的浓度为0.6 mol·L-1,根据化学方程式中化学计量数比,可算出B的变化浓度为0.3 mol·L-1,进而确定B的浓度是1 mol·L-1-0.3 mol·L-1=0.7 mol·L-1;A的变化浓度为0.6 mol·L-1,从而求A的转化率为30%;用C表示的反应的平均速率为0.3 mol·L-1·s-1,可推知用A表示的反应的平均速率为0.3 mol·L-1·s-1,用B表示的反应的平均速率为0.15 mol·L-1·s-1。对照各选项,符合题意的是B。
答案:B
[例2] (2006天津理综,11) 某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) Z(g)+W(s)∶ΔH>0下列叙述正确的是( )
Z(g)+W(s)∶ΔH>0下列叙述正确的是( )
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
解析:本题综合了影响化学反应速率和化学平衡的因素。固体或纯液体浓度改变,对化学反应速率和化学平衡都没有影响,A不正确;由于该反应为气体总体积缩小的反应,所以当压强不变时,表明气体物质的量不变,反应已达平衡;该反应为吸热反应,温度升高平衡向正反应方向移动;反应热是物质间完全反应时的数值,与平衡移动无关。
答案:B
[例3] (2006江苏,16) 某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如图1-2-6所示的变化规律(图中P表示压强,T表示温度,n表示物质的量):
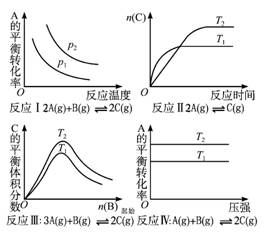
图1-2-6
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:ΔH>0,P2>P1 B.反应Ⅱ:ΔH<0,T1<T2
C.反应Ⅲ:ΔH>0,T2>T1;或ΔH<0,T2<T1 D.反应Ⅳ:ΔH<0,T2<T1
解析:反应(Ⅰ),温度升高,A的转化率降低,说明化学平衡向逆反应方向移动,则正反应为放热反应,ΔH<0;在温度一定时,增大压强,化学平衡向正反应方向移动,A的转化率增大,即P2>P1,A不正确。由题给反应(Ⅱ)的图示知T1>T2温度升高,n(C)减少,平衡向逆反应方向移动,正反应放热,ΔH<0,B正确。若反应(Ⅲ)为放热反应,C的体积分数减少时,平衡向逆反应方向移动,则T2<T1,反之亦然,C正确。同理,对于反应(Ⅳ),若ΔH<0,则因A的转化率减少,所以T1>T2。
答案:BC
链接·提示
化学平衡图象问题的识别分析方法,不外乎是看坐标、找变量、想方程、识图象四个方面,即准确认识横、纵坐标的含义,根据图象中的点(起点、终点、转折点)、线(所在位置的上下、左右、升降、弯曲)特征,结合题目中给定的化学方程式和数据,应用概念、规律进行推理判断。
[例4] (2006年5月徐州模拟题) 在某温度时将2
mol A和1 mol B两种气体通入容积为2 L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g),2 min时反应达到平衡状态,经测定B的物质的量为0.4
mol,C的反应速率为0.45 mol·(L·min)-1。下列各项能表明该反应达到平衡的是( )
xC(g),2 min时反应达到平衡状态,经测定B的物质的量为0.4
mol,C的反应速率为0.45 mol·(L·min)-1。下列各项能表明该反应达到平衡的是( )
A.vA正∶vB逆=2∶1 B.混合气体密度不再变化
C.混合气体压强不再变化 D.A的转化率不再变化
解析:本题的关键是首先根据题给A、B起始的物质的量、平衡时B的物质的量和C的反应速率等数据求得x=3,再判断反应是否达到平衡。化学平衡状态的根本标志是v正=v逆(同一物质),因此需要把A项中原来的vA正和vB逆换算成用同一物质表示的形式,因为vA逆∶vB逆=2∶1,令vB逆=1,则vA逆=2,这样A项就有关系:vA正=vA逆,符合平衡标志。
答案:AD
链接·拓展
由于对正反应速率、逆反应速率及由不同物质表示的反应速率等概念理解不深不透,易造成对本题干扰选项的判断失误。此题是对化学平衡状态标志的考查。判断是否达到平衡状态的标志有:
(1)直接标志?

(2)间接标志
①通过总量:对Δn(g)≠0的反应,n总(或 恒温恒压下的V总、恒温恒容下的P总) 不变
②通过复合量: 、ρ(
、ρ( ),分析关系式 中上、下两项的变化
),分析关系式 中上、下两项的变化
③其他:如平衡体系颜色等(实际上是有色 物质浓度)
[例5]
一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2 mol A和2
mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2 mol A和2
mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
A.2 mol C
B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol A、3 mol B和3 mol C
解析:本题主要考查考生对等效平衡及平衡的移动原理的理解,侧重考查考生分析问题的能力。该反应为反应前后体积不变的反应,A项中若将2 mol C全部转化为A、B,分别得到 mol A和
mol A和 mol B,与起始加入的2 mol A和2 mol B比较,A项中相当于少加了B,使A的转化率减小,A的百分含量增加;B项中,加入He对平衡无影响,也相当于少加了B而使A的转化率减小,使A的百分含量增加;由C项的投料情况看,反应只能逆向进行,而1 mol B对逆向反应有抑制作用,致使生成的A减少,百分含量减小;D项中若按2
mol A、2 mol B和3 mol C投料与原来2
mol A、2 mol B投料等效,多余1 mol B使A的转化率增大,百分含量减小。故选A、B。
mol B,与起始加入的2 mol A和2 mol B比较,A项中相当于少加了B,使A的转化率减小,A的百分含量增加;B项中,加入He对平衡无影响,也相当于少加了B而使A的转化率减小,使A的百分含量增加;由C项的投料情况看,反应只能逆向进行,而1 mol B对逆向反应有抑制作用,致使生成的A减少,百分含量减小;D项中若按2
mol A、2 mol B和3 mol C投料与原来2
mol A、2 mol B投料等效,多余1 mol B使A的转化率增大,百分含量减小。故选A、B。
答案:AB
3.反应物用量的改变对平衡转化率的影响规律
若反应物只有一种时,如:aA(g)B bB(g)+cC(g),增加A的量,平衡向正反应方向移动,但该反应物A的转化率的变化与气体物质的计量数有关:
bB(g)+cC(g),增加A的量,平衡向正反应方向移动,但该反应物A的转化率的变化与气体物质的计量数有关:
(1)若a=b+c A的转化率不变
(2)若a>b+c A的转化率增大
(3)若a<b+c A的转化率减小
若反应物不止一种时,如aA(g)+bB(g) cC(g)+dD(g)
cC(g)+dD(g)
(1)若只增加A的量,平衡向正反应方向移动,而A的转化率减小,B的转化率增大。
(2)若按原比例同倍数地增加反应物A和B的量,则平衡向正反应方向移动,而反应物转化率与气体反应物计量数有关。如果a+b=c+d,则A、B的转化率都不变;如果a+b<c+d,则A、B的转化率都减小;如果a+b>c+d,则A、B的转化率都增大。
链接·思考
化学平衡主要是研究可逆反应规律的,如反应进行的程度以及各种条件对反应进行程度的影响等。(1)为什么说化学平衡是动态平衡?(2)有人设想通过寻找高效催化剂的途径提高化工生产中原料的转化率,这一设想科学吗?(3)为什么在实验室中很难得到纯净的NO2气体?
答:(1)化学平衡的主要特点是v(正)=v(逆),由于正反应和逆反应仍在继续进行,只是在同一瞬间,正反应生成某生成物的分子数和逆反应所消耗的该物质的分子数相等,此时反应混合物中各组分的浓度不变。故化学平衡是一种动态平衡。
(2)催化剂能同等程度地改变v(正)和v(逆),因此它只能缩短反应达到平衡所用的时间,不能改变反应物的转化率,故(2)说法不正确。
(3)由于NO2与N2O4之间存在如下转化关系:2NO2 N2O4,故通常情况下NO2气体中也会存在少量N2O4,由于以上转化是放热过程,故只有在高温低压情况下,NO2气体才相对较纯。
N2O4,故通常情况下NO2气体中也会存在少量N2O4,由于以上转化是放热过程,故只有在高温低压情况下,NO2气体才相对较纯。
2.改变条件对化学平衡的影响规律
(1)在相同温度下,对有气体参加的化学反应,压强越大,到达平衡所需的时间越短;在相同压强下,温度越高,到达平衡所需的时间越短。
(2)平衡向正反应方向移动,生成物的物质的量增加。而生成物的浓度、生成物的质量分数以及反应物的转化率都不一定增加或提高。
(3)加催化剂,只能同倍地改变正、逆反应速率,改变到达平衡所需的时间,不影响化学平衡。
(4)同一反应中,未达平衡以前,同一段时间间隔内,高温时生成物含量总比低温时生成物含量大(其他条件相同)。高压时生成物的含量总比低压时生成物的含量大(其他条件相同)。
(5)在其他条件不变时,如将已达平衡的反应容器体积缩小到原来的 ,压强将大于原来的压强,但小于或等于原来压强的2倍。
,压强将大于原来的压强,但小于或等于原来压强的2倍。
1.外界条件对可逆反应速率的影响规律
升温,v(正)、v(逆)一般均加快,吸热反应增加的倍数大于放热反应增加的倍数;降温,v(正)、v(逆)一般均减小,吸热反应减小的倍数大于放热反应减小的倍数。加压对有气体参加的反应,v(正)、v(逆)均增大,气体体积之和大的一侧增加倍数大于气体体积之和小的一侧增加的倍数;降压,v(正)、v(逆)均减小,气体体积之和大的一侧减小的倍数大于气体体积之和小的一侧减小的倍数。增加反应物的浓度,v(正)急剧增大,v(逆)逐渐增大。加催化剂可同倍地改变v(正)、v(逆)。
28.中国和俄罗斯都是国际舞台上的重要力量。俄罗斯联邦总统梅德韦杰夫于2008年5月23日至24日对我国进行国事访问。胡锦涛主席与梅德韦杰夫总统举行会谈。双方重申,发展长期稳定的中俄战略协作伙伴关系是两国对外政策的优先方向,符合中俄两国和两国人民的根本利益,有利于两国的发展与繁荣,对地区及世界的和平、稳定与发展也具有重要意义。
(注:中俄战略协作伙伴关系,是不结盟、不对抗、不针对第三国的新型国家关系。它以加强政治互信、深化经济合作、扩大人文交往与合作、密切在国际事务中的协调与配合等为主要内容。)
结合上述材料,运用所学政治常识相关知识,回答下列问题。(12分)
(1)说明中俄战略协作伙伴关系体现的我国外交政策的基本内容。(6分)
(2)结合材料分析中俄深化战略协作伙伴关系的原因。(6分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com