
5.在三棱柱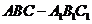 中,各棱长相等,侧掕垂直于底面,点
中,各棱长相等,侧掕垂直于底面,点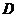 是侧面
是侧面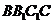 的中心,则
的中心,则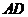 与平面
与平面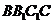 所成角的大小是 ( )
所成角的大小是 ( )
A.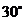 B.
B.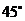 C.
C.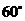 D.
D.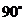
4.
如果函数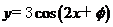 的图像关于点
的图像关于点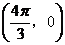 中心对称,那么
中心对称,那么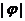 的最小值为
的最小值为
(A)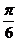 (B)
(B)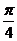 (C)
(C)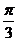 (D)
(D) 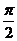 w
w
3.
设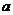 、
、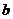 、
、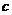 是单位向量,且
是单位向量,且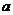 ·
·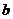 =0,则
=0,则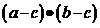 的最小值为
( )
的最小值为
( )
(A)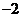 (B)
(B)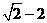 (C)
(C)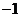 (D)
(D)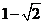
2.已知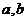 是实数,则“
是实数,则“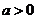 且
且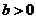 ”是“
”是“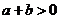 且
且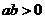 ”的
( )
”的
( )
A.充分而不必要条件 B.必要而不充分条件
C.充分必要条件 D.既不充分也不必要条件
1.设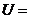
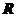 ,
,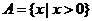 ,
,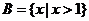 ,则
,则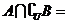 ( )
( )
A.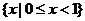 B.
B.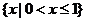 C.
C.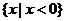 D.
D.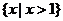
20. (12分)
(12分)
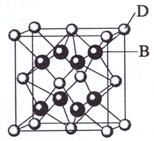
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
19. (10分)硝酸铜受热易分解:2Cu(NO3)2  2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO
2CuO+4NO2↑+O2↑,当温度达到800℃时,CuO开始分解:4CuO  2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2=2NO+O2等反应)。
2Cu2O+
O2↑,至1000℃以上,CuO完全分解(加热过程中忽略2NO2⇌N2O4,2NO2=2NO+O2等反应)。
现取5.64gCu(NO3)2无水晶体,在一定温度下使其分解,将生成的气体及时导出并用足量的NaOH溶液充分吸收。
(1)若该质量的无水硝酸铜经加热完全分解,其中的铜元素全部转化为氧化铜,则氧化铜的质量是_____________。
(2)若该质量的无水硝酸铜完全分解,铜元素全部转化为氧化亚铜,反应过程中生成的气体被足量的NaOH溶液充分吸收后,还有多余的气体,则多余的气体是______________(填分子式),其体积(标准状况)是_____________L,
(3)若该质量的无水硝酸铜分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是______________________g。
(4)设该质量的无水硝酸铜在分解过程中,得到的残留固体质量为xg,生成的气体中NO2和O2的体积比为y,求y与x的关系式: ;
。
18.(12分)从物质A开始有如图所示的转化关系(其中部分产物已略去)。已知H能使溴的CCl4溶液褪色;1mol F(分子式C4H6O2)与足量新制的Cu(OH)2在加热条件下充分反应可生成2mol Cu2O。分析图表并回答问题:
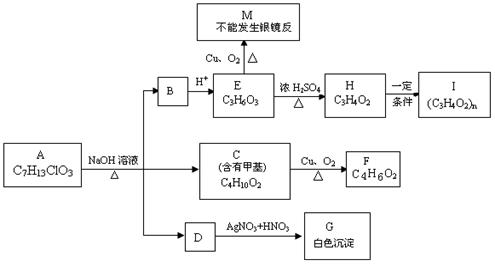
(1)A的结构简式可能为: 、 ;
(2)写出反应类型:E→H ;H→I ;
(3)写出C→F的化学方程式: 。
(4)请设计出由丙烯合成CH3-CH(OH)-COOH的反应流程图(无机试剂任选,有机物用结构简式表示)。
提示:①合成过程中无机试剂任选;②反应流程图表示方法示例如下:
17. 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
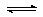 C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与 有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应
 CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650 |
2 |
4 |
1.6 |
2.4 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
1.6 |
3 |
|
3 |
900 |
a |
b |
c |
d |
t |
①实验1中以v(CO2) 表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
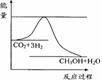 CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
CH3OH(g)+H2O(g) ,右下图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是___________。
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2
16.(16分)硫酸钡是唯一的无毒的钡盐,工业上以硫酸钡等为原料通过下列流程反应可以制备锌钡白(BaSO4+ZnS)和过氧化氢:(皓矾为ZnSO4•7H2O)
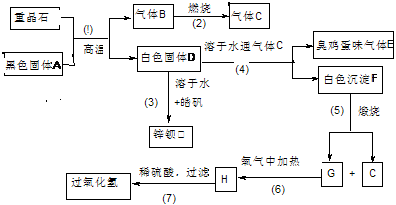
(1)上述流程中共有7个化学反应,其中有____________个属于氧化还原反应。
(2)写出过氧化氢和物质C的电子式:____________________,_______________。
(3)写出F、G的化学式: F_____________、G_________________。
(4)写出下列化学反应方程式:
反应③__________________________________________________________。
反应⑦____________________________________________________。
(5)取锌钡白固体16.5g溶于100mL 1mol/L的H2SO4 溶液中,放出H2S 气体1008mL(已折算成标准状况)
①不计溶液体积变化,所得溶液中氢硫酸的物质的量浓度为________mol/L
②加热驱尽溶液中H2S 后,为使锌离子完全沉淀,应加入 1 mol/L的NaOH溶液_____mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com