
23、(10分)(1)下列各情况,在其中Fe片腐蚀由快到慢的顺序是
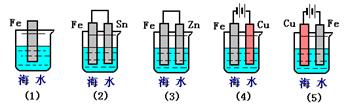
(2)已知某可逆反应mA(g)+nB(g)
 qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
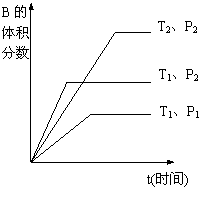 (①、②、③题填“>”、“<”或“=”):
(①、②、③题填“>”、“<”或“=”):
①温度的关系:T1________T2;
②压强的关系:P1________P2;
③化学计量数的关系:m+n______q;
④该反应的正反应为___________反应。(填“吸热”或“放热”)
(3)已知: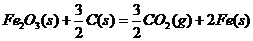 △
△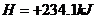 ·
·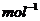
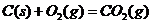 △
△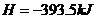 ·
·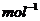
则铁和氧气反应生成氧化铁的热化学方程式是
22.硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是( )
|
实验 |
反应温度/℃ |
Na2S2O3溶液 |
稀H2SO4 |
H2O |
||
|
V/mL |
c/(mol·L-1) |
V/mL |
c/(mol·L-1) |
V/mL |
||
|
A |
25 |
5 |
0.1 |
10 |
0.1 |
5 |
|
B |
25 |
5 |
0.2 |
5 |
0.2 |
10 |
|
C |
35 |
5 |
0.1 |
10 |
0.1 |
5 |
|
D |
35 |
5 |
0.2 |
5 |
0.2 |
10 |
第Ⅱ卷 非选择题(共56分)
21.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( ) (已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e- == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
20、H2和CO2在高温下发生发应:CO2(g)+H2(g) CO(g)+H2O(g)。下表是9860C时,在容积不变的密闭容器中进行反应的四组数据:
CO(g)+H2O(g)。下表是9860C时,在容积不变的密闭容器中进行反应的四组数据:
|
编号 |
起始浓度/mol·L-1 |
平衡浓度/mol·L-1 |
||||||
|
c0(H2) |
c0 (CO2) |
c0 (H2O) |
c0 (CO) |
[H2] |
[CO2] |
[H2O] |
[CO] |
|
|
1 |
1.0 |
1.0 |
0 |
0 |
0.44 |
0.44 |
0.56 |
0.56 |
|
2 |
1.0 |
2.0 |
0 |
0. |
0.27 |
1.27 |
0.73 |
0.73 |
|
3 |
0 |
0 |
2.0 |
2.0 |
0.88 |
0.88 |
1.12 |
1.12 |
|
4 |
0.2 |
0.4 |
0.6 |
0.8 |
0.344 |
0.544 |
0.456 |
0.656 |
下列叙述中正确的是( )。
①该温度下反应的平衡常数约为1.6;②该反应的平衡常数与反应的起始浓度无关;③增大CO2的起始浓度,可使CO2的转化率增大;④从反应开始至达到平衡状态,混合气体的密度没有发生改变。
A. ②③ B. ①②③ C. ①②④ D.①③
19、下列对化学平衡移动的分析中,不正确的是 ( )
 ①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量
①已达平衡的反应C(s)+H2O(g) CO(g)+H2(g),当增加反应物物质的量
时,平衡一定向正反应方向移动
 ②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正
②已达平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正
反应方向移动,N2的转化率一定升高
③有气体参加的反应平衡时,若减小反应器容积时,平衡一定向气体体积增大的方向
移动
④有气体参加的反应达平衡时,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④ B.①②③ C.②③④ D.①②③④
18、将分别盛有熔融氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )。
A.1∶2∶3 B. 3∶2∶1 C. 6∶3∶1 D. 6∶3∶2
16、汽车尾气净化中的一个反应如下:

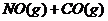
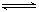
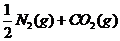
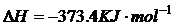
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:( )
|
|
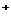 的高分子材料。这种锂离子电池的电池反应为:
的高分子材料。这种锂离子电池的电池反应为: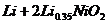
 下列说法不正确的是(
)
下列说法不正确的是(
)
A.放电时,负极的电极反应式:Li-e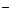 =Li
=Li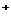
B.充电时,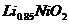 既发生氧化反应又发生还原反应
既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li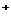 向负极移动
向负极移动
15、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: 负极:Pb+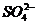 = PbSO4+2e-
= PbSO4+2e-
正极:PbO2+4H++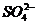 +2e- = PbSO4+2H2O
+2e- = PbSO4+2H2O
今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A. 0.025 mol B. 0.050 mol C. 0.10 mol D. 0.20 mol
14、可以将反应Zn+Br2 = ZnBr2设计成蓄电池,下列4个电极反应
①Br2 + 2e- = 2Br- ②2Br--2e- = Br2 ③Zn-2e- = Zn2+ ④Zn2+ + 2e- = Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和① C.③和① D.④和①
13.已知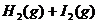
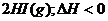 有相同容积的定容密闭容器甲和乙,甲中加入
有相同容积的定容密闭容器甲和乙,甲中加入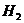 和
和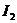 各1mol ,乙中加入HI2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
各1mol ,乙中加入HI2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B 甲中加入1mol He,乙不变
C.甲降低温度,乙不变 D 甲增加1mol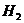 ,乙增加1mol
,乙增加1mol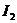
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com