
2、 质量守恒的理解 反越位和生成物的总质量不变
质量守恒的理解 反越位和生成物的总质量不变
 宏观
宏观
元素的种类不变
 (1)五个不变
原子的种类不变
(1)五个不变
原子的种类不变
微观 原子的数目不变
原子的质量不变
 宏观:物质的种类一定改变
宏观:物质的种类一定改变
(2)两个一定改变
微观:分子的种类一定改变
(3)可能改变:分子总数可能改变。
1、基本内容:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
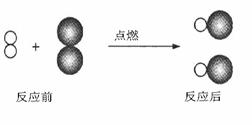
3、(2009·临沂)如果用“ ”表示氢原子,用“
”表示氢原子,用“  ”表示氯原子,如右图所示。请用化学方程式表示这个反应 ,该反应类型是
”表示氯原子,如右图所示。请用化学方程式表示这个反应 ,该反应类型是

2、(2008·长沙)下列反应属于化合反应的是 ( )
A、Zn + H2SO4==
ZnSO4+H2↑ B、CaCO3高温CO2↑ + CaO 
 C、CH4 + 2O2点燃CO2 + 2H2O D、S+O2点燃SO2
C、CH4 + 2O2点燃CO2 + 2H2O D、S+O2点燃SO2
1、(2009·东营)某种元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应。据此可判断下列化学反应属于氧化还原的有( )
A.ZnO+H2SO4=ZnSO4+H2O
B.Fe2O3+3CO====2Fe+3CO2
C.Na2CO3+2HCl=2NaCl+H2O+CO2↑ D.CaCO3 高温 CaO+CO2↑
4、四种基本反应类型与氧化还原反应、中和反应
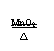 (1)氧化还原反应交叉于分解反应、化合反应和置换反应中,不属于哪种基本类型。如复分解反应中有氧化还原反应,也有非氧化还原反应[例如:2KClO3
(1)氧化还原反应交叉于分解反应、化合反应和置换反应中,不属于哪种基本类型。如复分解反应中有氧化还原反应,也有非氧化还原反应[例如:2KClO3
2KCl+3O2↑(氧化还原反应);H2CO3 = H2O + CO2↑(非氧化还原反应)]同样化合反应中有氧化还原反应,也有非氧化还原反应,置换反应都属于氧化还原反应(到高中学习),复分解反应都属于非氧化还原反应。
(2)中和反应是酸和碱作用生成盐和水的反应。是复分解反应的特例。
[例3](2009·达州)我国使用“长征3号甲”运载火箭将“嫦娥Ⅰ号”送上月球轨道,该运载火箭的动力是由高氯酸铵(NH4ClO4)分解所提供的,反应方程式为2NH4ClO4===N2↑+Cl2↑+4H2O↑+2O2↑,请判断该反应的基本反应类型是( )
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
[答案]A
[解析]根据化学方程式2NH4ClO4===N2↑+Cl2↑+4H2O↑+2O2↑,可知反应物只有一种,生成物有四种,所以属于分解反应。
[规律小结]判断反应的基本类型,主要依据时各类反应的定义:化合反应:“多变一”,分解反应:“一变多”,置换反应:“一换一”,复分解反应:“两两互换成分”。
变式训练三
2、初中常见化学反应的基本类型形式归纳
(1)化合反应
1非金属单质与氧气生成非金属氧化物。如:2H2+O2  H2O
H2O

2金属与氧气反应生成金属氧化物。如:3Fe+2O2
 Fe3O4
Fe3O4 
3金属氧化物与水反应,生成相应的碱。如:CaO+H2O=
Ca(OH) 2
4非金属氧化物与水反应,生成相应的酸。如:CO2+H2O= H2CO3

5其它。 如:2CO+ O2  2CO2等。
2CO2等。
(2)分解反应
1氧化物的分解 例如:2H2O2MnO22H2O
+ O2↑
2酸的分解(含氧酸)
例如:H2CO3
= H2O + CO2↑
3某些盐的分解 例如:
CaCO3高温CO2↑+ CaO
(3)置换反应
1活泼金属(金属为金属活动顺序中氢以前的金属)与酸(酸不包括浓硫酸和硝酸)反应生成盐和氢气。
例如:Fe+2HCl=FeCl2+H2↑ H2SO4 + Zn =
ZnSO4+ H2↑
2金属(一般不选K、Na、Ca)和盐溶液反应生成另一金属和另一种盐。
例如:Fe+CuSO4=FeSO4+Cu 2AgNO3+Cu= Cu(NO3)2 +2Ag
3氢气还原金属氧化物。例如:H2+CuO△ Cu+H2O
4碳还原金属氧化物。例如:2CuO+C高温 Cu+CO2↑
(4)复分解反应

1碱性氧化物 + 酸反应 → 盐 + 水
例如:Fe2O3+6HCl= 2 FeCl3+3H2O 
2碱 + 酸 → 盐 + 水(中和反应) 例如:H2SO4 +2
NaOH =Na2SO4 +2 H2O
3酸 + 盐 → 另一种酸
+ 另一种盐 例如:HCl +AgNO3=AgCl↓ + HNO3 
4碱 + 盐 → 另一种碱 + 另一种盐
例如:2NaOH+CuSO4
= Cu(OH)2↓
+Na2SO4 
5盐 + 盐 → 两种新盐 例如:NaCl+AgNO3 =AgCl↓+NaNO3 
注意:碱+酸性氧化物--盐+水,不属于复分解反应。
例如:2NaOH+CO2 = Na2CO3 + H2O 
1、化学反应的基本类型比较
|
反应类型 |
概 念 |
特 征 |
举例 |
|
化合反应 |
由两种或两种以上的物质生成另一种物质的反应。 |
A+B→AB 多变一 |
S+ O2 SO2 SO2 |
|
分解反应 |
一种物质生成两种或两种以上其它物质的反应。 |
AB→A+B 一变多 |
2H2O电解2H2↑+O2↑ |
|
置换反应 |
一种单质跟一种化合物反应生成另一种单质和另一种化合物 |
A+BC→B+AC 一换一 |
HCl+ Zn= ZnCl2 + H2↑ |
|
复分解反应 |
两种化合物相互交换成分,生成两种新化合物的反应。 |
AB+CD→AD+BC 成分相交换 |
H2SO4+2NaOH =Na2SO4+2H2O |
2、(2009·东营)物质的用途与性质密切相关。下列说法不正确是( ) 
A.铜用于制导线,是由于铜有良好的导电性

B.氮气常用作保护气,是由于氮气的化学性质不活泼 
C.二氧化碳用于灭火,是由于二氧化碳不可燃、不助燃且密度比空气大 
D.铁制品表面涂“银粉”(铝粉)防生锈,是由于铝的化学性质比铁稳定 
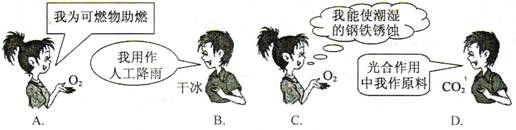
1、(2009·金华)下列关于O2和CO2的“自述”中,属于物理性质的是( )

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com