
2.医生向人体内发射频率已知的超声波,超声波被血管中的血液反射后又被仪器接收,测出反射波的频率的变化,就能知道血液的流速,这种方法在医学上叫做彩超,它应用的原理是
A.多普勒效应 B.声波的干涉 C.声波的衍射 D.回声
1.下列说法正确的是 ( )
A.布朗运动反映了微粒中分子运动的不规则性
B.对不同种类的物体,只要温度相同,分子的平均动能一定相同
C.分子间距离增大时,分子之间的引力增大而斥力减小
D.一定质量的气体,温度升高时,分子之间的平均距离一定增大
20.(14分)运用化学反应原理研究氮、硫、氯、碘等单质及其化合物的反应有重要意义。
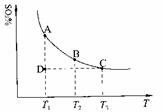
 (1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 ①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
①2SO2(g)+O2(g) 2SO3(g)的△H 0(填“>”或“<”);若在恒温、
恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或
“不”);
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1 K2;若反应进行到状
态D时,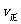
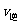 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
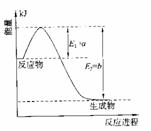 (2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
①右图是一定的温度和压强下是N2和H2反应生成
1molNH3过程中能量变化示意图,请写出工业合成氨
的热化学反应方程式: 。
(△H的数值用含字母a、b的代数式表示)
②氨气溶于水得到氨水。在25°C下,将a mol·L-1
的氨水与b mol·L-1的盐酸等体积混合,反应后溶液中
显中性,则c(NH+4) c(Cl-)(填“>”、“<”或“=”);用含a和b的代数式表示出氨水的电离平衡常数表达式 。
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在。在25°C下,向0.1mol·L-1的NaCl溶液中逐滴加入适量的0.1mol·L-1硝酸银溶液,有白色沉淀生成。从沉淀溶解平衡的角度解释产生沉淀的原因是 ,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(已知25°C时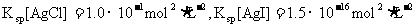 )
)
19.(7分)自2009年3月起,从墨西哥、美国等国逐渐扩散到全世界的甲型H1N1型流感暴发疫情,引起了全球关注和积极应对。防控专家表示,含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
(1)过碳酸钠是一种有多用途的新型氧系固态漂白剂,化学式可表示为
Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为 ,H2O2被称为“绿色氧化剂”的理由是 。
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO-4、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→O2。写出该反应的离子方程式(不必配平): 。
(2)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1molClO2生成时转移的电子个数是 。
18.(13分)下列为元素周期表的一部分,表中阿拉伯数字(1、2……)是原周期表中行或列的序号。请参照元素A~I在表中的位置,回答下列问题。
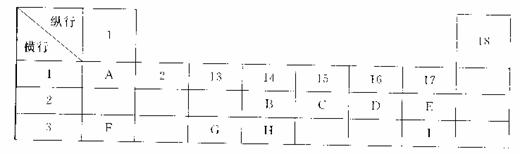
(1)B、C两元素中非金属性较强的是 (写出元素名称),请设计一个简单的实验证明这一结论 。
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M。写出Z与Y反应的化学方程式: 。
 (4)I元素在周期表里的位置在第 周期、第 族。
(4)I元素在周期表里的位置在第 周期、第 族。
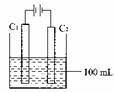
实验室中采用右图所示装置模拟工业上同时制取元素A和I
的单质过程:
①写出电极C1上发生反应的电极反应式 。
②当电极上产生112mL(标准状况)元素I单质气体时(假设
气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。
(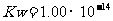 )
)
17. (13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
(13分)实验室中需要22.4 l(标准状况)SO2气体。化学小组同学依据化学方程式Zn+
2H2SO4(浓) ZnSO4+SO2↑+2H2O计算后,取65.0g锌粒与98%的浓H2SO4(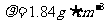 )110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
)110mL充分反应锌全部溶解,对于制得的气体,有同学认为可能混有杂质。
(1)化学小组所制得的气体中混有的主要杂质气体可能是 (填分子式)。产生这种结果的主要原因是
(用化学方程式和必要的文字加以说明)
(2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。
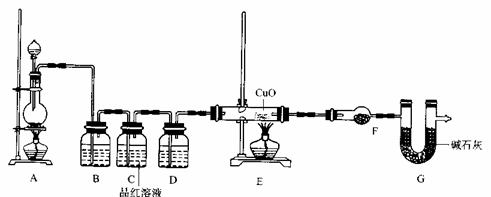
①装置B中加入的试剂 ,作用是 。
②装置D加入的试剂 ,装置F加入的试剂 。
③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是 。
④U型管G的作用为 .
16.(8分)(1)化学是一门以实验为基础的学科,化学实验是化学学习的重要内容。根据你掌握的知识判断,下列实验操作的描述中,正确的是 。(填写下列各项序号)
A.从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶
B.用稀盐酸洗涤盛放过石灰水的试剂瓶
C.配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸
D.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量
E.Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中
F.将用水润湿的pH试纸,浸人稀盐酸溶液,测定溶液的pH
(2)化学实验中,不正确的操作会对实验结果的准确性造成一定的影响,请用“>”、“<”或“一”填写下列空白:
①实验时未用标准液润洗滴定管,则测得锥形瓶中待测液的浓度 实际浓度。
②用托盘天平称取10.4 g氯化钠,若将砝码和氯化钠的位置放颠倒了,所称取氯化钠的质量为 10.4 g。
③用容量瓶配制500 mL0.1 mol·L-1。NaOH溶液,定容时仰视刻度线,所得溶液的物质的量浓度 0.1 mol·L-1。
15.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。已知:2Fe2++Br2===2Fe3++2Br- 2Fe3++2I-===2Fe2++I2 则下列有关说法中,不正确的是 ( )
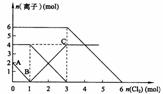 A.还原性:
A.还原性: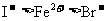
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
第Ⅱ卷(非选择题共5 5分)
14.向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
( )
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
13.甲、乙两烧杯中分别盛有10mL 1mol·L-1AlCl3溶液,在甲烧杯中加入一定量NaOH溶液;乙烧杯中加入与上述NaOH溶液等体积、等pH的氨水。下列有关两个烧杯的说法中,正确的是 ( )
A.甲中产生的沉淀一定比乙中多
B.乙中产生的沉淀一定比甲中多
C.甲和乙产生的沉淀一定一样多
D.甲和乙中产生的沉淀可能一样多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com