
4.(1)Ca(NO3)2受热分解的化学方程式:Ca(NO2)2、O2 (各1分)
(2)Cu(NO3)2受热分解的化学方程式: 2Cu(NO3)2 =2CuO+4NO2↑+O2↑(2分)
(3) Ⅱ正确(2分);气泡仅部分消失(1分),且剩余氧气等;(1分)
(4)硝酸盐受热分解的产物可能与盐中金属元素的活泼性有关(2分)。
亮点:(3)理由来自审题,(4)学生总结规律
4. 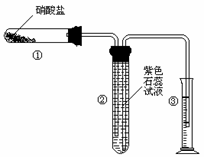 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
(1) 甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式: 、 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
 (3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
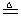 (Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3 2Ag2O+4NO2↑+O2↑,
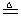 (Ⅱ)2AgNO3
2Ag+2NO2↑+O2↑。
(Ⅱ)2AgNO3
2Ag+2NO2↑+O2↑。
 Ⅰ、Ⅱ中正确的是 ,并说明理由:
。
Ⅰ、Ⅱ中正确的是 ,并说明理由:
。
请你设计一个简单的实验证明你的结论是正确的: 。
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
3. ⑴用冰水冷却有利于析出更多的晶体,黑暗可以防止晶体分解 ⑵过滤、洗涤
⑶100mL容量瓶、酸式滴定管 (紫)红 ⑷3 (每空2分)
3. 化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下的方法来制备这种材料并测定这种材料的组成。
Ⅰ.制备

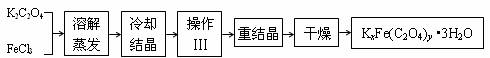
⑴结晶时应将溶液用冰水冷却并在黑暗处等待晶体的析出,这样操作的原因是:___________________________________________________________。
⑵操作Ⅲ的名称是___________。
 Ⅱ.组成测定
Ⅱ.组成测定
称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.1000 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00mL时恰好完全反应;再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应的化学方程式如下:
2 KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
⑶配制100mL 0.1000 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有___________________(填仪器名称)。两个滴定中,终点时溶液颜色为________色,且30 秒内不变色。
⑷该化合物KxFe(C2O4)y·3H2O中,x=_______。
2.(1) b c (2)Mn2++ClO-+H2O→MnO2↓+2H++Cl-; 促进Al3+、Fe3+水解
(3)Fe(OH)3、Al(OH)3(2分)(4)CaSO4·2H2O或CaSO4;以防MgSO4在温度低时结晶析出;漏斗、玻璃棒;降低CaSO4·2H2O的溶解度(或减少CaSO4·2H2O的溶解)
(5)Mg2+、Na+;循环利用;取滤液1-2 mL于试管中,加入BaCl2溶液,若有白色沉淀生成,说明有SO42-。
2. 利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁(MgSO4·7H2O),硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(g/100g水)
|
温度 / ℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:


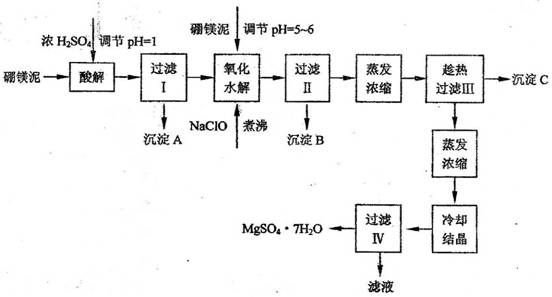
根据以上流程图并参考pH数据和溶解度数据,试回答下列问题:
(1)硼镁泥加入浓硫酸时,FeO发生的变化是 (选填序号)。
a.被钝化 b.被氧化 c.被溶解
(2)往过滤Ⅰ得到的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaClO溶液可将溶液中的Mn2+氧化成MnO2,该反应的离子反应方程式为 。加热煮沸的目的是_ 。
(3)沉淀B中除MnO2外还含有 (填化学式)等物质。
(4)沉淀C的化学式是_____________;产生沉淀C的操作需趁热进行的原因是
;洗涤沉淀需要的玻璃仪器有:烧杯、 ;若用乙醇代替水作洗涤剂洗涤沉淀C,原因是 。
(5)过滤出MgSO4·7H2O晶体的滤液中含有的金属阳离子有 ;生产中对该滤液的处理方法是 ;检验滤液是否含有SO42-操作是 。
1. 答案:⑴①②④③或②①④③ ⑵CaCO3+2H+==Ca2++CO2↑+H2O H++OH-==H2O
⑶250mL; 四次测定恰好需加入盐酸100mL,加之润洗滴定管、调整液面及排气泡等消耗,故需要溶液的量多于100mL。⑷60.0%
1. 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其它成分不与盐酸反应或氢氧化钠反应):
①配制0.100 mol·L-1稀盐酸和0.100mol·L-1NaOH溶液
②取一粒药片(0.100g)研碎后加入20.0ml蒸馏水
③用0.100 mol·L-1NaOH溶液中和,用去体积为Vml
 ④加入25.0 mL 0.100 mol·L-1稀盐酸。请回答下列问题:
④加入25.0 mL 0.100 mol·L-1稀盐酸。请回答下列问题:
 (1)测定过程的正确操作顺序为 (填序号)。
(1)测定过程的正确操作顺序为 (填序号)。
(2)测定过程中发生反应的离子方程式
(3)若某次实验需重复测定四次。实验室现有50ml、100ml、250ml、500ml四种规格的容量瓶,则配制盐酸应选用的容量瓶规格最好为 ,理由是
(4)某同学四次测定的V数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
Vml |
15.4 |
12.9 |
13.1 |
13.O |
请根据这位同学的实验数据,计算药片中碳酸钙的质量分数。
19、嘉园超市每天晚上10∶00停止营业,届时需广播提醒顾客。请你代写一则广播稿,准备在晚上9∶30播出,用以提醒顾客。(10分)
要求:语言得体,亲切自然,80字左右。
福建省龙岩市09-10学年高一上学期期末教学质量检查
18、仔细观察下面这幅锦旗,思考一下它的内容有何不妥,然后再加以改正。(6分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com