
18.(07年高考上海化学卷·24)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________________。
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是 mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
17.(08年上海化学·24)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外的反应物与生成物分别填如以下空格内。

(2)反应中,被还原的元素是 ,还原剂是 。
(3)将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。

(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
15.(08年天津理综·29)(1)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(2)称取6.0 g含H2C2O4·2H2O、KOH、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为___。KHC2O4的质量分数为___。
16.(08年江苏化学·16)根据下列框图回答问题(答题时,方程式中的M、E用所对应的元素符号表示):
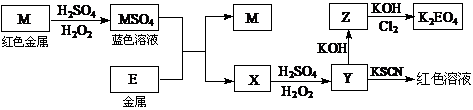
(1)写出M溶于稀H2SO4和H2O2混合液的化学方程式: 。
(2)某同学取X的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
(3)写出Cl2将Z氧化为K2EO4的化学方程式: 。
14.(08年全国理综I·26)实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3 在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4制备KMnO4的离子方程式是 。
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,计算KMnO4的理论产量 ;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是 。
(5)上述制得的KMnO4产品0.165g,恰好与0.335 g 纯Na2C2O4反应完全。计算该KMnO4的纯度。 。
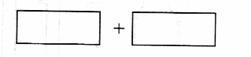
13.(09年上海化学·24)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为 。
(3)根据上述反应可推知 。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方
向和数目:
12.(07年高考全国理综卷II·11)下列氧化还原反应中,水作为氧化剂的是
A.CO+H2O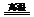 CO2+H2 B.3NO2+H2O
= 2HNO3+NO
CO2+H2 B.3NO2+H2O
= 2HNO3+NO
C.2Na2O2+2H2O = 4NaOH+O2↑ D.2F2+2H2O = 4HF+O2
11.(07年高考全国理综卷I·10)已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4 = 2CuI↓+13I2+12K2SO4+12H2O,其中1 mol氧化剂在反应中得到的电子为
A.10 mol B.11 mol C.12 mol D.13 mol
10.(08年上海化学·13)已知在热的碱性溶液中,NaClO发生如下反应:3NaClO→2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
9.(08年上海化学·6)下列物质中,按只有氧化性,只有还原性,既有氧化性又有还原性的顺序排列的一组是
A.F2、K、HCl B.Cl2、Al、H2 C.NO2、Na、Br2 D.O2、SO2、H2O
8.(08年海南化学·4)锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com