
(三)温度对金属与盐酸反应速率也有影响
取两个烧杯,分别加入等质量的 (“同种”、 “不同种”)金属,再分别加入足量的质量分数 (“相同”、 “不相同”)的稀盐酸……实验表明,温度越高,盐酸与金属反应的速率越快。
27.(5分)实验室有一包白色固体,可能含有无水硫酸铜、硫酸钠、碳酸钙、氯化钡、氯化钾中的一种或几种。现做如下实验:
a.取少量白色固体加足量的水溶解,过滤得沉淀和无色溶液。
b.向所得的沉淀中加入足量的稀硝酸,沉淀有部分溶解,并有气体产生,再过滤,滤液无色。
回答下列问题:
⑴.仅根据第一步实验现象的描述,你认为白色固体中无水硫酸铜______________。(选填“存在”、“不存在”或“不能确定”) 。
⑵.根据两步实验的现象,你认为该白色固体中一定不含有的物质是_________________,不能确定是否含有的物质是_________________,沉淀有部分溶解的化学反应方程式是_____________ 。
(二)金属与不同质量分数的盐酸反应的快慢不同
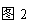 取质量相等的锌片,分别放入5%、20%的足量稀盐酸中。
取质量相等的锌片,分别放入5%、20%的足量稀盐酸中。
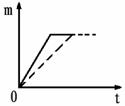 生成氢气的质量为m,反应时间为t。5%的盐酸与锌片反应m与t的关系曲线如图2所示。请在该图上补画出20%的盐酸与锌片反应m与 t的关系曲线。
生成氢气的质量为m,反应时间为t。5%的盐酸与锌片反应m与t的关系曲线如图2所示。请在该图上补画出20%的盐酸与锌片反应m与 t的关系曲线。
实验表明,盐酸质量分数越大,与金属反应的速率越快。
(一)不同金属与酸反应的快慢不同
取质量相等的上述两种金属,分别放入溶质质量分数相同的足量稀盐酸中,
生成氢气的质量(m)与反应时间(t)的关系曲线如图1所示。
 (1)金属活动性顺序表(填元素符号)
(1)金属活动性顺序表(填元素符号)
 K、Ca、Na、 、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
K、Ca、Na、 、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au
(2)线B对应的金属为 。
(3)线A对应的金属与稀盐酸反应的化学方程式 。
24.(5分)青少年正处在生长发育期,应注意营养均衡,膳食合理。
 (l)有些青少年不爱吃蔬菜、水果,影响生长发育,这主要是由于摄入___________(填序号)不足而引起的。 ①维生素 ②油脂 ③蛋白质
(l)有些青少年不爱吃蔬菜、水果,影响生长发育,这主要是由于摄入___________(填序号)不足而引起的。 ①维生素 ②油脂 ③蛋白质
(2)“××糕点”主要营养成分如下表所示。请根据该表回答。
①所含营养素中属于无机盐的是_________,没有列出的一类营养素是 。
②正常情况下,人每日摄入的油脂不超过60g,由此计算,每日食用该糕点最多不应超过__________g。
③糖类是人体所需__________的主要来源。
25. (5分)如图所示是甲、乙、丙三种物质的溶解度曲线,在20℃时,分别取等质量的三种物质的饱和溶液放入三只烧杯中,然后向溶液分别加入等质量的相应固体物质,再将温度升高到40℃,结果甲物质全部溶解,丙物质部分溶解,试回答下列问题:
(1)乙物质的溶解情况是 ________ ____ ____ _
(2)依次写出甲、乙、丙三种物质的溶解度曲线的序号: ;
(3)当温度在20℃~30℃时,三种物质的溶解度由大到小的顺序是_______________________;(用甲、乙、丙填空)
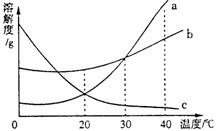 (4)40℃时,等质量饱和溶液中含水最少的是
物质。
(4)40℃时,等质量饱和溶液中含水最少的是
物质。
(5)40℃时,甲溶液中溶质质量分数__ __大于丙溶液中溶质质量分数;(填“一定”或“不一定”)。
26.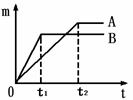 (6分)用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平。锌片、铁片、镁片。5%盐酸、20%盐酸。
(6分)用下列仪器和试剂验证影响金属与盐酸反应速率的因素:烧杯、试管夹、酒精灯、药匙、量筒、天平。锌片、铁片、镁片。5%盐酸、20%盐酸。
23.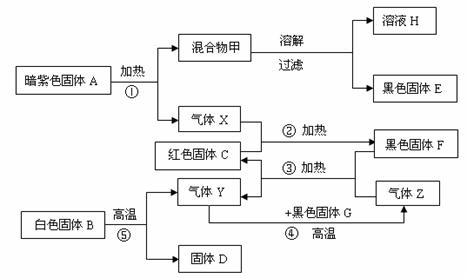 (9分)下图是常见物质间相互转化的关系图。
(9分)下图是常见物质间相互转化的关系图。
|
|
|
|
|
|
|
|
据上图关系回答:
(1)固体A的化学式为 B F 溶液H中溶质为
(2)④反应的基本类型是 反应。
(3)写出反应③④的化学方程式:③ ;
④ 。
22.(7分)(1)我们把直接从自然取得的能源称为一级能源,一级能源经过加工取得的能源称为二级能源。下列是目前正在利用和开发的部分能源 ①煤;②汽油;③天然气;④太阳能;⑤风能;⑥潮汐能;⑦地热能;⑧电能;⑨氢能;⑩酒精,其中不属于一级能源的是(填序号) 。
(2)我国是世界产煤大国。但含硫煤燃烧排放的SO2会引起“酸雨”现象。为减少大气污染,某发电厂采用了“石灰固硫法”,即向煤中掺入熟石灰,用来吸收SO2,写出“固硫法”反应的化学方程式 。
(3)科学家预言,氢能将成为21世纪的主要绿色能源,而水是自然界中广泛存在的物质,你认为获取氢气的最佳途径是 ,氢能源的优点有 、发热高、来源广、是再生能源等。
(4)电池是一种将 能转化为电能的装置。锂电池是一种新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐。某种锂电池的总反应式为Li + MnO2 = LiMnO2,其中化合价发生变化的元素是 。
21.(9分)(1)请用“氢、氧、碳、硫、钠”中的某些元素,按要求各写出一种常见物质的化学式:
①不可再生的气态化石燃料 ;②可用于制肥皂、造纸等工业的碱 ;
③生命活动中不可缺少的单质 ;④在氧气中燃烧发出蓝紫色火焰的固体 ;
⑤能用于金属除锈的重要化工原料 。
(2)请从上述①~⑤物质中选择适当的物质,各写出一个符合下列反应类型的化学方程式:
化合反应: ;
复分解反应: 。
20.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-。现取两份200 mL溶液进行如下实验:① 第一份加足量NaOH溶液,加热,收集到气体0.68 g;② 第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g。根据上述实验,以下推测正确的是
A.一定不存在Ba2+,NH4+可能存在 B.CO32-一定存在
C.Na+一定不存在 D.一定不存在Cl-
19.浩瀚无际的海洋为人类提供了丰富的资源。由海水制备金属镁,主要有以下步骤:①电解熔融的氯化镁;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④⑤③① B.③②④①⑤ C.③④②⑤① D.②④③⑤①
18.观察以下化学反应的微观示意图,下列说法不正确的是
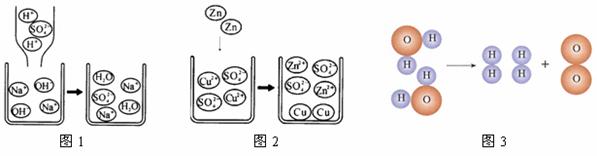
A.图1的反应,微观上是H+和OH-生成水分子以及Na+和SO42-生成Na2SO4分子的过程
B.图2中的反应,微观上是锌原子和铜离子生成锌离子和铜原子的过程
C.图3中的反应,微观上是分子破裂成原子,然后原子重新组合生成新分子的过程
D.上述所涉及的化学反应基本类型有复分解反应、置换反应、分解反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com