
2、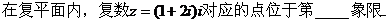
1、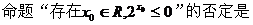 .
.
6、解析:实验者的目的是检验NO2气体中是否混有NO,若实验中途NO发生了转化,就无法确定NO是否在银元宝与硝酸的反应中生成,也就失去了检验的意义。因此第一步操作应排尽装置内的空气,以防NO被装置内的氧气所氧化。
若缺少B装置,则NO2或N2O4则会与C中冷凝后的水反应,生成NO,从而对NO的检验产生干扰。
反应结束后,由于D中存在未反应的NO,所以在导管口因接触空气中的氧气而变红色。升高温度,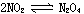 的平衡向左移动,NO2的物质的量增大,颜色加深。
的平衡向左移动,NO2的物质的量增大,颜色加深。
5、解析:(1) BaSO3可溶于盐酸或稀硫酸,注意在此不可用硝酸。(2)生成BaSO4一定发生了氧化还原反应,要考虑到可能的氧化剂。(4)要防止空气中氧气带来实验干扰。
答案:(1) 在白色浑浊物中加入过量盐酸,变澄清。(2分)
(2) Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4(2分)
(3)防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰。(2分)
(4) (a) SO2 +2Fe3++2H2O =SO42-+2Fe2++4H+(2分)
(b) Ba2++SO42-=BaSO4 ↓(2分)
技巧点拨:实验探究的原理和方法都来源于课本,解这类题关键是要接合已学知识,如反应条件,反应产物的可能性等,然后再结合题目中的实验要求和条件来综合分析.
4、解析:该实验是用CO2与氢氧化钠溶液完成的,因为CO2在水中的溶解度并不大,不能形成喷泉,A正确;表中数据显示NaOH浓度在<1.6mol/L前有浓度越大越易形成喷泉(形成喷泉所需时间短)的规律。B正确;表中数据显示NaOH浓度在>1.6mol/L时CO2已完全被吸收,生成的Na2CO3达最大值,水的体积没有达到烧瓶最大容量,是因为烧瓶中有导管等。所以C错。表中数据显示形成喷泉所需时间最短为6s,说明此时氢氧化钠已足量(或过量),当氢氧化钠浓度为1.4mol/L时仍不是最快的,故氢氧化钠浓度为1.0mol/L时为不足量,因此不能完全吸收CO2,溶液中无氢氧化钠剩余,烧瓶也不能充满,D正确。
答案:C
3、解析:本题以课本上硫酸亚铁晶体制备实验为起点,进一步拓展和提升来制备摩尔盐。
(1)中将铁屑在Na2CO3溶液中加热,Na2CO3溶液水解显碱性,可使铁屑上附着的油污水解而除去。在铁屑与稀硫酸的反应中,铁屑过量,故得到的是硫酸亚铁,其物质的量等于硫酸的物质的量=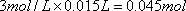 ;根据
;根据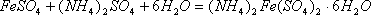 ,硫酸铵的质量为
,硫酸铵的质量为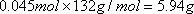
(2)中由于硫酸亚铁具有较强的还原性,易被氧化,故在制备过程中必须避免与空气接触。在所有制备结晶水合物的操作中,均不可剧烈加热,否则会失去结晶水。由提供的溶解度数据可知(NH4)2Fe(SO4)2·6H2O溶解度最小,加热浓缩,溶剂减少,(NH4)2Fe(SO4)2·6H2O便结晶析出。KMnO4酸性溶液因具有强氧化性,能氧化碱式滴定管中的橡胶,故只能装入酸式滴定管中。KMnO4酸性溶液的浓度根据5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O计算。
答案:(1)①铁屑表面的油污 ②硫酸亚铁 0.045 ③5.94
(2) ①a过滤洗涤操作速度要快 b步骤③要缓缓加热,避免沸腾 ②因为析出的是硫酸亚铁铵晶体,带有结晶水,蒸干会使晶体分解。③因为相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小 ④Ⅰ)酸式,右 Ⅱ) 5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O Ⅲ)当溶液变成紫红色,30S内不褪色,说明达到滴定终点 Ⅳ)1/V
2、解析 :加的氧化剂氧化Br-生成了Br2,由加入的CCl4可知,是在用萃取剂萃取CCl4,所以操作①的名称是萃取,紧接萃取后操作是将油层和水层分开的过程叫做分液;从含溴的CCl4溶液中分离得到CCl4和液溴的操作是将两种相互混溶的液体进行分离的操作叫做蒸馏。由溶解度图象知,将得到的溶液进行蒸发浓缩至
答案:(1)萃取;分液;蒸馏;玻璃棒、漏斗、烧杯;(2)冷水,B (3)快速充分。
1、答案:(14分)方法甲:研钵、泥三角、干燥器(各1分,共3分)
[交流与讨论]
(1)CuSO4·5H2O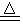 CuO+SO3+5H2O或CuSO4·5H2O
CuO+SO3+5H2O或CuSO4·5H2O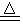 CuO+H2SO4+4H2O也可。(1分)
CuO+H2SO4+4H2O也可。(1分)
(2)吸水剂,加CaO后蒸馏(或蒸馏也可),冷凝管。(各1分,共3分)
(3)铜离子(或硫酸铜)对双氧水分解有催化作用。(1分)
(4)[问题一]浓硝酸,先撤去导管,后停止加热。(各1分,共2分)
[问题二]NO2+NO+Ca(OH)2=Ca(NO2)2+H2O或4NO2+2Ca(OH)2=Ca(NO3)2 +Ca(NO2)2
+2H2
 O
O
[问题三](2分)。
解析:方法甲考察固体研磨、加热的基本操作。
[交流与讨论]中(1)黑色固体物质只能是CuO ;(2)考察浓硫酸的性质与蒸馏的基本操作的仪器与注意事项。(3)一般情况下H2O2虽可分解,但需在MnO2催化作用下才有明显的现象,此处Cu2+ 或CuSO4对该反应起催化作用。
(4) 问题一、结合信息“逐渐加入浓HNO3的方法来制备CuSO4·5H2O”,则分液漏斗内盛浓硝酸。由于反应过程中有可溶于水的气体NO2生成,在撤导管时,操作不规范可以引起倒吸,应先撤导管再迅速撤加热装置。
6.近年来的许多研究证实,有机硝酸类药(如硝酸甘油)治疗心绞痛、心肌梗塞等心血管疾病,这类药的机理,它在体内转化过程中可产生NO,通过NO的作用,导致平滑肌松弛,血管舒张,血流量增加,使心肌性供血状况改善,病情得以缓解。
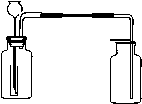
下图为某实验者设计的验证铜与浓硝酸反应,生成的NO2气体中含有NO的实验装置图。
已知:常温时,NO2与N2O4混合存在;在低于
⑴反应前先打开A部分的活塞k1,持续通一段时间N2,其理由是___________________
__________________________________________________。
⑵若装置中缺B部分,其后果是_______________________________________________。
⑶反应结束后,打开D部分的活塞k2,并通入氧气,D瓶内气体由无色变为红棕色;若通入的是热氧气,则瓶内气体的颜色比以前更深,其原因是____________________________________________________。
⑷C部分装置的作用是______________;E部分中a仪器所起的作用是________________。
5.问题提出:
小王同学有次实验时把SO2通入装有BaCl2、FeCl3的混合溶液的试管中,出现了白色浑浊物。
假设、验证:
|
|
假设 |
实验验证方法及现象 |
|
假设1 |
白色浑浊物是BaSO3。 |
(1)_____________________________
___________________________________ |
|
假设2 |
(2)白色浑浊物是BaSO4,主要 原因是 。 |
反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不 出现浑浊。滴加FeCl3溶液后出现浑浊 (3)通入纯净的CO2的目的_______________ |
请把上表填充完全.
(4)写出SO2通入BaCl2、FeCl3的混合溶液生成沉淀相关的离子方程式。
(a)
(b)___________________________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com