
4.原子结构的表示方法
⑴原子结构示意图:表示原子的核电荷数和核外电子在各电子层上排布的图示;⑵电子式:用“«”或“Δ在元素符号周围表示最外层电子的图示。
3.核外电子排布规律
⑴每一电子层最多容纳的电子数为2n2;⑵最外层电子数最多不超过8个,若K层为最外层,电子数最多不超过2个;⑶次外层电子数最多不超过18个;⑷倒数第三层最多容纳的电子数为32个;⑸电子能量低的离原子核近,电子能量高的离原子核远。
2.人们把具有一定数目的质子和一定数目的中子的一种原子叫做核素。同一元素的不同核素之间互称同位素。
同位素的特征:⑴同一元素的各种同位素质量数不同化学性质几乎完全相同。⑵在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子个数百分比一般是不变的。
1.原子的组成
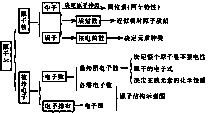 ⑴ 质子数=核电荷数=核外电子数=原子序数
⑴ 质子数=核电荷数=核外电子数=原子序数
⑵ 质量数(A)=质子数(Z)+中子数(N)
22.4.625 讲析:n(NaCl)=0.5mol,由Cl的平均相对原子质量为35.5,根据十字相乘法得37Cl的含量为1/4,则
m(37Cl-)=0.5mol╳(1/4)╳37g/mol=4.625g
21.⑴氧、氮 ⑵ m=3,n=2 ⑶O2
讲析:⑴由题意可知A为氧元素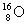 ,n(Am)=0.15mol,
,n(Am)=0.15mol,
Bn中含原子数 = Am = 0.15mol,M(B)=14g/mol。
∴B的原子量为14,则B元素为氮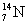
⑵根据同温同压下,任何两气体的体积比即物质的量之比的原理 n(Am):n(Bn)=2:3 ∴ m:n = 3:2
则:m=3 n=2 Am-O3 Bn-N2
⑶O3的一种同素异形体为O2
20.⑴Cl O ⑵KClO3
讲析:据化合价可知X为第IA族元素,Y为第VIIA族元素;
再根据Z元素原子核内质子数比Y元素原子核内质子数少9个,推测Y为Cl,Z为O;最后以ClO3-的电子总数为42验证此答案符合题意。
19.⑴I Na Cl ⑵Na2O Na2O2 Na2O+H2O==2NaOH
2Na2O2+2H2O==4NaOH+O2↑ ⑶置换 Cl2+2I-==2Cl-+I2
讲析:X为第VA族元素推知为I;据Y的氧化物的特性大胆假设A为Na,再根据计算验证之;Z为第VIIA族元素,根据性质推知为Cl。
18. A原子中存在原子核,它占原子中极小体积
B 原子核带正电荷,且电荷数远大于α-粒子
C金的原子核质量远大于α-粒子
17.⑴N2H4 ⑵ ⑶22 ⑷CO2、N2O、BeF2
讲析:⑴N2H4+ +OH- = N2H4 + H2O ⑵电子式的书写模仿NH4+ ⑶
N3-的电子总数=7╳3+1=22⑷以N原子为中心分析讨论。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com