
4.碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是 。
(2)A有2个不同的含氧官能团,其名称是 。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是 。
②A不能发生的反应是(填写序号字母) 。
a.取代反应 b.消去反应
c.酯化反应 d.还原反应
(4)写出两个与A具有相同官能团、并带有支链的同分异构体的结构简式: 。
(5)A还有另一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是 。
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
n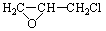 +nOHCH2CH2OH
+nOHCH2CH2OH
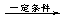
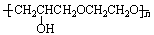 +nHCl
+nHCl
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是 。
3.已知有机物分子中的烯键可发生臭氧分解反应,例如:R-CH=CH-CH2OH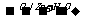 R-CH=O+O=CH-CH2OH。A的部分性质如下图所示:
R-CH=O+O=CH-CH2OH。A的部分性质如下图所示:
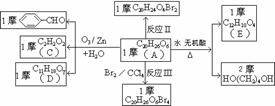
试根据上述信息结合所学知识写出A的结构简式。
2.A、B、C都是含C、H、O、N四种元素的有机化合物。1molA隔绝空气经加热分解后得到1molB和1molCO2,且有机物的质量减少了29.53%,B是天然蛋白质水解的最终产物,经红外光谱分析得知,B分子结构中不含甲基,除-COOH外,还含有一个-OH。C属于硝酸酯类化合物,又是B的同分异构体。回答下列问题:
(1)A的相对分子质量是___________;
(2)B的结构简式是____________;
(3)C可能的几种结构简式是_______________________
_______________________________________________。
1.1 mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1 molB和1 molC。B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中C原子数相同,且Mr(B)=Mr(C)+2。
(1)C的分子式为 ,A的摩尔质量为 ;
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式 ;
(3)C有多种同分异构体,其中属于酯类的同分异构体有
_____________种;
(4)C分子中苯环上有两个取代基,且苯环上的一氯取代物有两种。写出A的结构简式 。
2. 有机物分子结构的确定--物理方法(波谱法)
化学方法以官能团的特征反映为基础,鉴定出官能团,还要制备它的衍生物以进一步确认其结构。当化合物结构比较复杂时,往往要耗费大量时间。物理方法(波谱法)具有微量、快速、准确、信息量大等特点。(1)质谱--可快速、准确测定有机物的相对分子质量。(2)红外光谱--可以获得分子中含有何种化学键或官能团的信息。⑶核磁共振氢谱--可推知有机物分子中有几种不同类型的氢原子及它们的数目之比。
[典型例析]
例1:已知某有机物 A 的式量为 128。
(1)若 A 物质中只含有碳、氢、氧三种元素,且 A 分子中含有一个酯的结构,则 A 的分子式为__________,结构简式为____________(任写出一种)。
(2)若 A 物质中只含有碳、氢、氮三种元素,且 A 分子中氮原子数目最少,则 A 的分子式为__________,若 A 分子中有一个由氮原子和其他碳原子形成的六元环,则 A 的结构简式为__________(任写一种)。
变式训练:
某有机物仅含C、H、N三种元素,其相对分子质量不超过200,其中氮元素的质量分数为10.85%,下列关于该有机化合物的说法正确的是
A.可能是芳香烃 B.不可能是芳香族化合物
C.该物质的熔点较高 D.分子结构中可能只含有单键
例2:A是烃,B是烃的含氧衍生物,A、B均为常见的有机物。由等物质的量A和B组成的混合物0.05 mol在0.125 mol O2中恰好完全燃烧生成0.1 mol CO2和0.1 mol H2O。试回答下列问题:
⑴混合物中A、B的组合可能有_________种。
⑵另有一种组合的A和B,以任意比混合,且物质的量之和为a mol。①若耗氧量一定,则A、B的分子式分别是A_________,B_________,耗氧量为_________mol(用a表示)。②若生成的CO2和H2O的物质的量一定,则A、B的分子式分别是A_________,B_________。③若生成CO2的量为定值,则生成物H2O的质量范围为_________(用a表示)。
变式训练:
现有0.1 mol某有机物A在8.96 L O2中充分燃烧后,气体体积变为6.72 L,通过足量碱石灰吸收后剩余2.24 L(气体体积均在标准状况下测定)。
(1)燃烧后所得混合气体中CO2的物质的量为___________,2.24L剩余气体可能是________或___________;
(2)若A是烃,其化学式可能是_______或_______;若A是烃的衍生物,其化学式可能是_______或_______。
(3)若A由丁醛(C4H8O)与气体B等物质的量混合得到,则气体B的化学式为_______。
例3:胡椒酚A是植物挥发油中的一种成分。某研究性学习小组对其分子组成结构的研究中发现:A 的相对分子质量不超过150;A中C、O的质量分数分别为:w(C)=80.60%,w(O)=11.94%,完全燃烧后产物只有CO2和H2O。根据以上信息,填写下列内容:
(1)A的摩尔质量为 。
(2)光谱分析发现A中不含甲基(-CH3),苯环上的一氯取代只有2种;1molA与足量溴水反应,最多消耗3molBr2。A的结构简式为 。
(3)A的一种同分异构体中,苯环上含有两个取代基,取代基位置与A相同,且能发生银镜反应。
①符合条件的A的同分异构体的结构简式 。
②上述A的一种同分异构体发生银镜反应的化学方程式 。
变式训练:
有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
(1)若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
(2)若A由四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
(3)若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
[当堂反馈]
1. 有机物分子结构的确定--化学方法
由于有机化合物中存在同分异构现象,除少数的分子式只对应一种结构外,一般一种分子式对应有多种结构。我们常从以下两方面确定其结构:
(1)根据有机物的特殊反应,确定物质分子中的官能团,从而进一步确定其结构。常见有机物中,能使酸性高锰酸钾溶液褪色的烃类物质有烯烃、炔烃、苯的同系物;能与溴水产生白色沉淀有机物是苯酚;能发生与银氨溶液或新制Cu(OH)2反应的物质有醛类、甲酸、甲酸某酯、葡萄糖、麦芽糖等;能与碳酸钠反应产生气体的有机物是羧酸。
(2) 有机物实验式的确定
①实验式(又叫最简式)是表示化合物分子所含各元素的原子数目最简单整数比的式子。
②若有机物分子中 w(C)=a%、w(H)=b%、w(O)=c%,则:N(C) : N(H) : N(O)=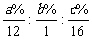 ,即可得到实验式。实验式也可以通过燃烧产物的物质的量等方法确定。确定实验式前必须先确定元素的组成,如某有机物完全燃烧的产物只有 CO2 和 H2O,则其组成元素可能为C、H 或 C、H、O;若燃烧产物 CO2 中的碳元素的质量和燃烧产物 H2O 中氢元素的质量之和等于原有机物的质量时,则原有机物组成中不含O元素。
,即可得到实验式。实验式也可以通过燃烧产物的物质的量等方法确定。确定实验式前必须先确定元素的组成,如某有机物完全燃烧的产物只有 CO2 和 H2O,则其组成元素可能为C、H 或 C、H、O;若燃烧产物 CO2 中的碳元素的质量和燃烧产物 H2O 中氢元素的质量之和等于原有机物的质量时,则原有机物组成中不含O元素。
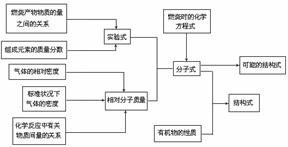
(3)确定有机物分子式和结构式的过程可简单归纳如下:
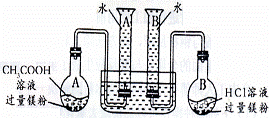
9.(08山东省威海市模拟)(15分)某校科技活动小组用镁粉、
盐酸、醋酸设计以下实验,对两种
酸分别与镁反应的速率和电离平衡
理论进行研究,设计的实验装置如
图所示(夹持固定装置已略去)。
正确操作,记录得到下表中部分实验数据。
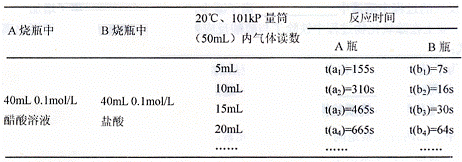
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于 经小组研究后,稍作改进就可继续实验了;
(2)改进装置后,如何检查一侧装置的气密性?
方法是: ;
(3)欲配进100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是 ;
(4)在实验数据中
①t(a1)远远大于t(b1)的原因为: ;
②由 [用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸不存在电离平衡;由 [用含t(b1)、t(b2)、t(b3)代数式表示]说明醋酸中存在电离平衡。
(5)该实验得到什么结论?(回答出两点即可)
①
②
(6)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氨气的量,可以加入 (填写两种不同作用原理的物质)。
答案 (1)量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)。
(2)将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气。
(3)容量瓶(100mL);玻璃棒
(4)①开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
②t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
(其它表示形式只要正确均给分)
(5)相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)。
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
(6)CH3COONa固体、水或NaCl溶液
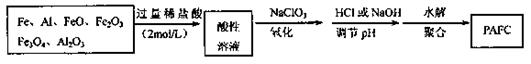 10.(08山东省威海市模拟)(14分)Ⅰ.一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)uCl6-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业来生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
10.(08山东省威海市模拟)(14分)Ⅰ.一种新型高效净水剂PAFC(聚合氯化铁铝[AlFe(OH)uCl6-n]m),广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业来生产废料(金属铁、铝及其氧化物)为原料制取PAFC,设计生产流程如下:
请回答下列问题:
(1)下列关于PAFC的说法正确的是 (填编号);
A.PAFC是一种无机高分子化合物
B.PAFC中Fe显+2价
C.PAFC溶于水能电离出OH-,是一种碱
D.PAFC在强酸性和强碱性溶液中均不能稳定存在
(2)写出上述流程中酸性溶液加入NaClO3时,发生反应的离子方程式:
。
Ⅱ.如右图所示,一定条件下将1molO2气体和2mol SO2
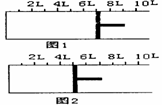 气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:
气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:
 2SO2(g)+O2(g) 2SO3(g),其中△H<0。
2SO2(g)+O2(g) 2SO3(g),其中△H<0。
当反应达到平衡时,活塞位置如图2所示,则达
到平衡时,SO2转化率为 ;该条件下
反应平衡常数为 。
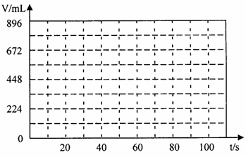 Ⅲ.某含0.02molNaCl与0.02molCuSO4的混合溶液200mL,常温下在恒定电压和电流的情况下进行电解,当40s时,阴极开始产生气体,100s时电解结束,此时两极产生的气体体积理论上相同,请在下图中画出阴阳两极产生气体的体积(已换成标准状况下的体积)与时间的关系图。
Ⅲ.某含0.02molNaCl与0.02molCuSO4的混合溶液200mL,常温下在恒定电压和电流的情况下进行电解,当40s时,阴极开始产生气体,100s时电解结束,此时两极产生的气体体积理论上相同,请在下图中画出阴阳两极产生气体的体积(已换成标准状况下的体积)与时间的关系图。
电解结束时是,消耗水的质量为
;溶液的pH为
;(体积的变化
忽略不计)
8.(山东省平度一中高三测试)(8分)化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
 2NO(g) N2(g)+O2(g)
K1=1×1030
2NO(g) N2(g)+O2(g)
K1=1×1030
 2H2(g)+O2(g) 2H2O(g) K2=2×1081
2H2(g)+O2(g) 2H2O(g) K2=2×1081
 2CO2(g) 2CO(g)+O2(g) K3=4×10-92
2CO2(g) 2CO(g)+O2(g) K3=4×10-92
请填写下列空白:
(1)常温下,NO分解产生O2的反应的平衡常数表达式为 ;
(2)常温下,水分解产生O2,此时平衡常数的数值约为 ;
(3)常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为
;
(4)随着轿车进入家庭,汽车尾气污染成为备受关注的环境问题,某市政府要求全市新有汽车尾气处理装置完成改装,改装后的尾气处理装置主要是加了有效催化剂。请你根据以上的有关数据分析,仅使用催化剂 (填“能”或“否”)消除污染气体。
答案 (1)K=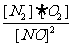 (2)5×10-82
(2)5×10-82
(3)NO>H2O>CO2 (4)能(每空2分,共8分)
7.(08山东省威海市08质量检测)(7分)在实验室中做如下实验:将物质A、B按一定比例充入一个表面积为800cm2,容积为2L的球形容器中,压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:2A(g)+B(g) 2C(g);△H=-180kJ·mol-1;
(1)若平均每分钟生成0.5molC,容器表面向外散热速率平均为400J·min-1·cm-2,为了维持恒温t℃,平均每分钟需用加热器提供 kJ的热量。
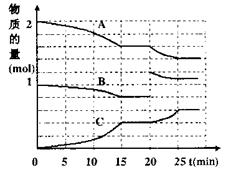 (2)将2molA与1molB充入上述2L反应容器中,反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示:
(2)将2molA与1molB充入上述2L反应容器中,反应过程中A(g)、B(g)、C(g)物质的量变化如右图所示:
①20min时发生变化的条件是 ;
A.加入催化剂
B.降低温度
C.缩小了容器体积
D.增加了B物质的量
②在15min达到平衡,此时平衡常数
K= (用分数表示)。若保持
体系温度为t℃,则随着反应的进行,
K值 。(填“增大”、“减少”、
“不变”)
③若起始时在此2L容器中充入1.2mol A(g)、0.6mol B(g)和0.8mol C(g),维持恒温t℃,达到平衡时C(g)的百分含量较原平衡 (填“增大”、“减少”、“不变”)。
答案 (1)275kJ(2分)
(2)①D ②5/32L·mol-1 (2分) 不变
③不变
6. (08山东临沂质量检测一) (10 分) 将不同量的H2O(气) 和CO 气体分别通入到一体积为l L的恒容密闭容器中进行反应:H2O (g) + CO( g)  CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
CO2 (g) +H2(g);得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO |
|||
|
1 |
650℃ |
1 mol |
2 mol |
0.8 mol |
1.2 mol |
5 min |
|
2 |
900℃ |
0.5 mol |
1 mol |
0.2 mol |
0.8 mol |
3 min |
|
3 |
900℃ |
a |
b |
c |
d |
t |
( 1 ) ①由以上数据,实验1中以v( CO2) 表示的反应速率为 。
②该反应在650℃时平衡常数数值为 ,该反应的逆反应为 (填“吸” 或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t < 3min,
则a、b 应满足的关系是 。
(2)下图1、2 表示上述反应在时刻t1达到平衡,在时刻t2因改变某个条件而发生变化的 情况:
①图1中时刻t2发生改变的条件可能是 (写一条即可,下同)。
②图2中时刻t2发生改变的条件可能是 。
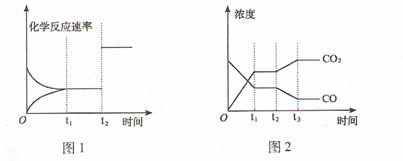
(3) 在850℃时,其平衡常数K = 1,850℃时在该容器中同时充人1.0moICO,3.0 molH2O,1.0molCO2,5.0molH2,此时反应向 (填“正反应” 或“逆反应”)方向进行,平衡时CO2的物质的量为 。
答案. (1)①0.16 mol•L-1•min-1 ② 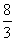 放 ③2a=b>1
放 ③2a=b>1
(2)①增大压强 ②降低温度
(3)逆反应 0.8 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com