
9.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )
A.SO2和SiO2 B.CO2和H2O
C.NaCl和HCl D.CCl4和KCl
8.实现下列变化,需克服相同类型作用力的是( )
A.碘和干冰升华 B.二氧化硅和生石灰熔化
C.氯化钠和铁熔化 D.苯和乙烷蒸发
7.某物质的晶体中,含A、B、C三种元素,其排列方式如右图所示(其中前后两面心上的B原子不能画出),晶体中A、B、C的原子个数比依次为 ( )
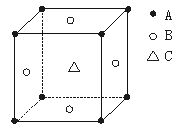
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
6.下列叙述中正确的是( )
A.离子晶体中肯定不含非极性共价键
B.原子晶体的熔点肯定高于其他晶体
C.由分子组成的物质其熔点一定较低
D.原子晶体中除去极性共价键外不可能存在其他类型的化学键
5.下列性质中,能较充分说明某晶体是离子晶体的是( )
A.具有高的熔点 B.固态不导电,水溶液能导电
C.可溶于水 D.固态不导电,熔化状态能导电
4.实现下列变化,需克服相同类型作用力的是 ( )
A.石墨和干冰的熔化 B.食盐和冰醋酸的熔化
C.液溴和水的汽化 D.纯碱和烧碱的熔化
3.下列物质中,含有共价键的离子晶体是 ( )
A.NaCl B.NaOH
C.NH4Cl D.I2
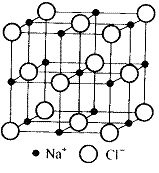
2.食盐晶体如右图所示。在晶体中,· 表示Na+,o 表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
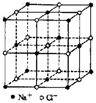 ( )
( )
A. 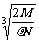 cm
B.
cm
B. 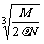 cm
cm
A. 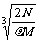 cm
D.
cm
D. 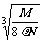 cm
cm
1. 由钾和氧组成的某种离子晶体中含钾的质量分数为78/126,其阴离子只有过氧离子(O22-)和超氧离子(O2-)两种。在此晶体中,过氧离子和超氧离子的物质的量之比为( )
A. 2︰1 B. 1︰1 C. 1︰2 D. 1︰3
3.均摊法确定晶体的化学式
在学习晶体时和在一些考试中,我们会遇到这样一类试题:题目中给出晶体的-部分(称为晶胞)的图形,要求我们确定晶体的化学式.求解这类题,通常采用均摊法.
均摊法是先求出给出的图形(晶胞)中平均拥有的各种粒子(离子或原子)的数目,再计算各种粒子数目的比值,从而确定化学式.
均摊法有如下规则,以NaCl的晶胞为例:
①处于顶点的粒子,同时为8个晶胞所共有,所以,每个粒子只分摊1/8给该晶胞.
②处于棱上的粒子,同时为4个晶胞所共有,所以,每个粒子只分摊1/4给该晶胞.
③处于面上的粒子,同时为2个晶胞所共有,所以,每个粒子只分摊1/2给该晶胞.
④处于晶胞内部的粒子,则完全属于该晶胞.
由此算出在NaCl的晶胞中:
含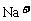 数:
数: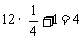
含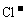 数:
数: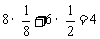
故NaCl晶体中,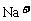 和
和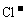 数目之比为1∶1.
数目之比为1∶1.
例题解析
例1.下列性质中,可以证明某化合物内一定存在离子键的是( )
A、可溶于水 B、具有较高的熔点
C、水溶液能导电 D、熔融状态能导电
解析:本题考查对化学键------离子键的判断。只要化合物中存在离子键必为离子晶体,而离子晶体区别其它晶体的突出特点是:熔融状态下能导电,故D正确;至于A可溶于水,共价化合物如:HCl也可以;B具有较高熔点,也可能为原子晶体,如SiO2;C水溶液能导电,可以是共价化合物如硫酸等。
答案: D
例2.参考下表中物质的熔点,回答下列问题。
|
物 质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物 质 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SbCl4 |
PbCl4 |
|
熔点(℃) |
-90.4 |
-70.2 |
5.2 |
120 |
-70.2 |
-49.5 |
-36.2 |
-15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤离子及碱金属离子的__ 有关,随着 增大,熔点依次降低.
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与 有关,随着 增大, 增强,熔点依次升高.
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与 有关,因为一般 比 熔点高.
解析:本题主要考查物质溶沸点的高低与晶体类型和晶体内部微粒之间作用力的关系以及分析数据进行推理的能力。
(1)表中第一栏的熔点明显高于第二栏的熔点,第一栏为IA元素与ⅦA元素组成的离子晶体,则第二栏为分子晶体。
(2)分析比较离子晶体熔点高低的影响因素:
物质熔化实质是减弱晶体内微粒间的作用力,而离子晶体内是阴、阳离子,因此离子晶体的熔化实际上是减弱阴、阳离子间的作用力--------离子键,故离子晶体的熔点与离子键的强弱有关。从钠的卤化物进行比较:卤素离子半径是r(F-)<r(Cl-)<r(Br-)<r(I-),说明熔点随卤素阴离子半径的增大而减小。又从碱金属的氯化物进行比较:碱金属阳离子半径是r(Na+)<r(K+)<r(Rb+)<r(Cs+),说明熔点随碱金属阳离子半径的增大而减小。
(3)分析比较分子晶体熔点高低的影响因素:
分子晶体内的微粒是分子,因此分子晶体的熔点与分子间的作用力有关。
从硅的卤化物进行比较:硅的卤化物分子具有相似的结构,从SiF4到SiI4相对分子量逐步增大,说明熔点随化学式的式量的增加而增大。
由从硅、锗、锡、铅的氯化物进行比较:这些氯化物具有相似的结构,从SiCl4到PbCl4相对分子质量逐步增大,说明熔点随化学式的式量的增加而增大。
答案:第一问 半径,半径
第二问:相对分子质量,相对分子质量,分子间作用力。
第三问:晶体类型,离子晶体,分子晶体。
例3.(1)中学化学教材中图示了NaCl晶体结构,它向三维空间延伸得到完美晶体。NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7g/mol)。
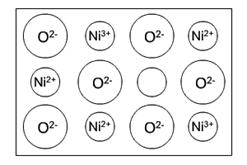
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。某氧化镍样品组成Ni0.97O,试计算该晶体中Ni3+ 与Ni2+的离子个数之比。
解析:(1)如图所示,以立方体作为计算单元,此结构中含有Ni2+--O2-离子数为:4×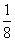 =
=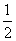 (个),所以1mol NiO晶体中应含有此结构的数目为6.02×1023÷
(个),所以1mol NiO晶体中应含有此结构的数目为6.02×1023÷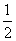 =12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3, 所以1mol NiO的体积为12.04×1023×(a×10-8cm)3 ,NiO的摩尔质量为74.7g/ mol,所以NiO晶体的密度为
=12.04×1023(个),又因一个此结构的体积为(a×10-8cm)3, 所以1mol NiO的体积为12.04×1023×(a×10-8cm)3 ,NiO的摩尔质量为74.7g/ mol,所以NiO晶体的密度为
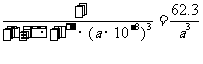 (g/cm3)
(g/cm3)
(2)解法一(列方程):设1mol Ni0.97O中含Ni3+为x mol, Ni2+为y mol , 则得
x+y=0.97 (Ni原子个数守恒)
3x+2y=2 (电荷守恒)
解得x=0.06 , y=0.91 故n (Ni3+) :n(Ni2+) = 6 :91
解法二(十字交叉):由化学式Ni0.97O求出Ni的平均化合价为2/0.97,则有
Ni3+ 3 0.06 /0.97

 2 / 0.97
2 / 0.97
 Ni2+ 2
0.91 / 0.97
Ni2+ 2
0.91 / 0.97
故 n (Ni3+) :n(Ni2+) = 6 :91。
解法三 直接分析法
依题意,一个Ni2+空缺,另有两个Ni2+被两个Ni3+取代。由Ni0.97O可知,每100个氧离子,就有97个镍离子,有三个Ni2+空缺,也就有6个Ni2+被Ni3+所取代,所以Ni3+有6个,Ni2+为97-6=91个。即Ni3+与Ni2+之比为6:91。
解法四 鸡兔同笼发
从Ni0.97O可知,假如有100个氧离子,就有97个镍离子,假设这97个镍离子都是+2价,那么正价总和为194价,负价总和为200价。为什么还差+6价呢?
这是因为多假设6个+2价的镍离子。实际上有Ni3+6个、Ni2+91个。所以Ni3+与Ni2+的个数比为6:91。
说明:求解晶体结构计算题,空间三维立体想象是关键。要运用分割、增补等手段。借此类题的中心思想是把化学问题抽象成数学问题来解决。
[基础训练]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com