
1.AC 2.C 3.B 4.D 5.C 6.BD 7.D
讲析:1.除杂原理是除去杂质,但主要物质不参与反应,不引入新杂质。主要物质与其他物质容易分离,NO2与水反应转化成NO。NH4Cl与过量的NaOH溶液反应,除去了NH4Cl,但由于NaOH过量,引入了新杂质。氧气与加热的Cu反应生成CuO固体。白磷燃烧放热使红磷燃烧。 2.由反应NO2+NO+2NaOH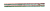 2NaNO2+H2O 可知V(NO2)、V(NO)体积比为1:1时,完全被碱溶液吸收,当NO2过量时,继续发生反应2NO2+2NaOH
2NaNO2+H2O 可知V(NO2)、V(NO)体积比为1:1时,完全被碱溶液吸收,当NO2过量时,继续发生反应2NO2+2NaOH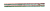 NaNO3+NaNO2+H2O,能被碱溶液吸收。当NO过量时就不能被碱溶液吸收了。 3.氧化还原反应中化合价的升降总数应相等。氮元素共升高8价,氧元素共升高4价,所以金属元素应该生高4价。答案:B。4.H2S和SO2反应生成S和H2O(l),气体的物质的量减少。NO和O2反应气体物质的量减少。Cl2和HI反应生成HCl和I2固体,气体物质的量减少。Cl2和H2S反应生成HCl和S固体,气体物质的量不变。 7. 22.4mLNO和11.2 mlO2恰好完全反应生成NO2,部分NO2继续反应生成N2O4,气体由NO2和N2O4组成。标况下,d(NO2)=2.054g/L d(N2O4)=4.108g/L
NaNO3+NaNO2+H2O,能被碱溶液吸收。当NO过量时就不能被碱溶液吸收了。 3.氧化还原反应中化合价的升降总数应相等。氮元素共升高8价,氧元素共升高4价,所以金属元素应该生高4价。答案:B。4.H2S和SO2反应生成S和H2O(l),气体的物质的量减少。NO和O2反应气体物质的量减少。Cl2和HI反应生成HCl和I2固体,气体物质的量减少。Cl2和H2S反应生成HCl和S固体,气体物质的量不变。 7. 22.4mLNO和11.2 mlO2恰好完全反应生成NO2,部分NO2继续反应生成N2O4,气体由NO2和N2O4组成。标况下,d(NO2)=2.054g/L d(N2O4)=4.108g/L
所以,气体的密度在2.054g/L~4.108g/L.答案:D。
6.白磷、P4。五氧化二磷、P2O5,偏磷酸、HPO3,
磷酸、H3PO4。
新活题网站
5.(1)弱碱性。(2)易燃烧。(3)H3AsO4,AsH3,74.9,略。讲析:同周期的元素从左往右,元素的金属性逐渐减弱,非金属性逐渐增强,非金属元素的氢化物的酸性增强,碱性减弱。氨水呈碱性。Si的非金属性比P弱,所以氢化物稳定性差,易燃烧。
1.C 2.B 3.A 4.C
讲析:1.氮分子由于原子之间有三个共价键,键能很大,所以氮分子很稳定,但氮元素非金属性很强,在氮族元素中非金属性最强。在化学反应中磷单质比氮气活泼。氮气性质稳定,可以做保护气,液氮可做冷冻剂。 2.由一种元素形成的不同种单质,互称为同素异形体.质子数相同,中子数不同的原子,互称为同位素.A为同位素,B为同素异形体.C、D是由同种元素组成的不同种物质。3.本题是根据分子式的计算,由元素的质量比列式计算出化合价。
17. (2002年高考综合题)已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.103 g,用硝酸处理,使磷转化成磷酸根。再加入某试剂,使磷酸根又转化成沉淀。沉淀经灼烧后得到组成为P2Mo24O77的固体(其式量以3.60 ×103计)0.504 g。试由上述数据计算该骨灰样品中磷的质量分数。(磷的相对原子质量以31.0 )
16.将V毫升NO和NO2的混合气体通过水吸收后,得到a毫升无色气体A,将此无色气体A与等体积的O2混合,再通过水充分吸收后收集到5毫升无色气体B。试回答:①A、B为何种气体?②A气体的体积是多少毫升?③V的取值范围。
15.实验室中要测定某无色气体的成份,已知此气体可能由CO2、NH3、NO2、N2、NO中的一种或几种混合而成。将此无色气体进行以下实验:①先通过盛有浓硫酸的洗气瓶,发现气体减少一部分体积;②继续通过装有Na2O2固体的干燥管,发现从干燥管出来的气体颜色呈红棕色;③再继续将气体通入盛满水倒立于水槽中的试管内,最后气体完全被吸收,试管内仍为一满试管液体。由此可判断:
(1)原气体中一定含有 ,一定不含有 。
(2)写出②中发生反应的化学方程式
。
(3)由最终结果可知原气体中 和 的体积比为 。
14.将硼砂(Na2B4O7)与NH4Cl共热,再用盐酸,热水处理,可得到白色固体氮化硼(BN)。
(1)配平反应方程式:
□Na2B4O7+□NH4Cl = □NaCl+□B2O3+2BN+□H2O
(2)BN是一种新型无机材料,它有两种晶体结构,金刚石型的BN可作耐磨材料,它应具有的性质是 ;石墨型BN可作润滑材料,它应具有的晶体结构为
。
13.如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式。
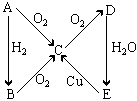
(1)当A为气体单质时,A是 ,B是 ,
C是 ,
D是 ,
E是
E→C化学方程式: 。
(2)当A为固体单质时,A是 ,B是 , C是 ,D是 ,E是 。
E→C化学方程式: 。
12.将20ml NO2和NH3的混合气体在一定条件下充分反应,化学方程式是6NO2+8NH3==7N2+12H2O,已知参加反应的NO2比NH3少2ml(气体体积均在相同条件下测定)。则原混合气体中NO2和NH3的物质的量之比是
A.3∶2 B.2∶3
C.3∶7 D.3∶4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com