
4. 文中作者运用了借物抒情(或托物言志)的写法,把“莲花”比喻“君子”_________的高尚品格。
在我国很多古诗词中,也用到了这种手法,如李白在《闻王昌龄左迁龙标遥有此寄》诗中用“_____,______”抒发对友人绵绵不尽的深情;李商隐在《无题》诗中用“_____,_______” 表达了坚贞的爱情;龚自珍在《己亥杂诗》中,用“____;_______” 展示了诗人不畏挫折、不甘沉沦,始终要为国家效力的坚强性格和献身精神。(8分)
3. 陶渊明“独爱菊”,周敦颐“独爱莲”,表现了他们处世态度有何异同?(5分)
相同:_______________________________________________________________________
不同:_________________________________________________________________________
2. 翻译下面文言句子。(4分)
菊之爱,陶后鲜有闻。__________________________
予独爱莲之出淤泥而不染,濯清涟而不妖。____________________
1. 解释下列加点字的意思。(3分)
⑴ 甚蕃________________ ⑵ 亵玩________________ ⑶ 宜乎众矣________________
36、(6分)白色粉末A由NaNO3、Na2SO3、Na2SO4三种物质中的一种或几种混合而成。取A样品,投入100 mL 2.2 mol/L硫酸(过量)中,使它们在密闭容器中充分反应。反应后测得,反应中产生的896mL(标准状况下)纯净的无色气体不能使品红溶液褪色,该气体遇空气变为红棕色;反应后的溶液中只含有一种酸根阴离子,且其物质的量浓度为3.1 mol/L。(设反应后溶液的体积仍为100mL)
(1)反应后溶液中酸根阴离子的化学式为______________。
(2) 原A样品中含有的各物质的物质的量分别为?(要求写出简单运算过程)
35、实验室中有甲﹑乙两瓶丢失标签的无色溶液,其中一瓶是盐酸,另一瓶是碳酸钠溶液。为确定甲﹑乙两瓶溶液的成分及其物质的量浓度,现操作如下:
 ①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,其收集到CO2气体224mL﹙标况﹚。②量取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00mL,其收集到CO2气体112mL﹙标况﹚。
请回答:
(1)根据上述两种不同操作过程及实验数据可判断甲溶液是 (填名称)
(2)甲溶液的物质的量浓度为
mol﹒L-1
①量取25.00mL甲溶液,向其中缓缓滴加乙溶液15.00mL,其收集到CO2气体224mL﹙标况﹚。②量取15.00mL乙溶液,向其中缓缓滴加甲溶液25.00mL,其收集到CO2气体112mL﹙标况﹚。
请回答:
(1)根据上述两种不同操作过程及实验数据可判断甲溶液是 (填名称)
(2)甲溶液的物质的量浓度为
mol﹒L-1
乙溶液的物质的量浓度为 mol﹒L-1 ﹙忽略CO2在溶液中的少量溶解﹚。 (3)若用类似上述“互滴”的方式。
①将100 mL 3mol/L的NaAlO2溶液逐滴加入50mL12mol/L的HCl溶溶液中,充分反应。
发生反应的离子方程式为_______ 。
②将50mL12mol/L的HCl溶液逐滴加入100 mL 3mol/L的NaAlO2溶液中,充分反应。
两种混合方式生成沉淀的量是否相等_______(“相等”“不相等”)
34、本题由两部分组成
Ⅰ 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
O=O |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
498 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”):?SiC_________________Si;SiCl4_____________SiO2。
 (2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)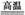 Si(s)+4HCl(g) 该反应的反应热ΔH=______________kJ·mol-1。
Si(s)+4HCl(g) 该反应的反应热ΔH=______________kJ·mol-1。
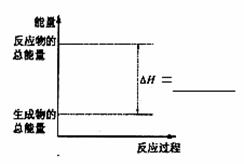
(3)请把右图表示固体Si在O2中完全燃烧生成SiO2
固体的能量变化图补充完整。
Ⅱ 某实验小组设计下列实验
A 分别配制250 mL 1.0 mol/L盐酸跟和250 mL 1.1 mol/L氢氧化钠溶液。
B 每次分别取用上述配制的盐酸50 mL跟和氢氧化钠50 mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
(1) 为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、250mL容量瓶(2个),还缺少的仪器有____ _ _
进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有________ _____
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得
的△H (填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50 mL,并记录如下原始数据。
|
实验序号 |
起始温度t1/℃ |
终止温度t2/℃ |
温差(t2-t1) /℃ |
||
|
盐酸 |
NaOH溶液 |
平均值 |
|||
|
1 |
25.1 |
24.9 |
25.0 |
31.6 |
6.6 |
|
2 |
25.1 |
25.1 |
31.8 |
31.8 |
6.7 |
|
3 |
25.1 |
25.1 |
25.1 |
31.9 |
6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容C=4.18×10-3 kJ/(g·℃),则该反应的热化学反应方程式为____________ ______。
33、(1)配平下列离子方程式: I-x+ Cl2+ H2O --- Cl-+ IO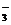 +
+
在反应中,若消耗I-x与Cl2物质的量之比为1∶8,则x=_____________。
(2)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液会发生如下反应:
Mn2++S2O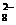 +H2O→MnO
+H2O→MnO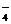 +SO
+SO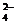 +H+
+H+
该反应常用于检验Mn2+的存在。其特征现象是__________________________,
若反应中有0.1 mol还原剂参加反应,则消耗氧化剂物质的量为_______________mol。
(3)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有_________________。
(4)将NaBiO3固体(黄色微溶)加入到MnSO4和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应:
NaBiO3+ MnSO4+ H2SO4- Na2SO4+ Bi2(SO4)3+ NaMnO4+ H2O
①配平上述反应的化学方程式,并标出电子转移的方向和数目;
②上述反应中还原产物是
32、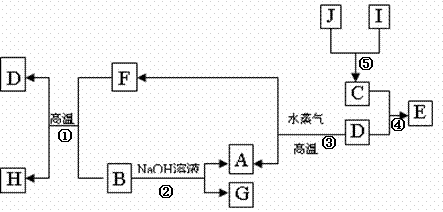 (16分)A.B.C.D是四种常见单质,其对应元素的原子序数依次增大,其中B.D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-I的所有物质之间有如下的转化关系:
(16分)A.B.C.D是四种常见单质,其对应元素的原子序数依次增大,其中B.D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-I的所有物质之间有如下的转化关系:
回答下列问题:
(1)写出物质 C的构成元素在周期表中的位置 ;
(2)写出B与F反应的化学方程式 。
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
。
用化学方程式表示该过程的原理: 。若要提纯该胶体,采用的操作方法叫 。此液体具有的性质是___________(填写序号字母)
a.光束通过该液体时形成光亮的“通路”
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧,得红棕色固体
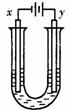 另取少量上述胶体置于U型管中,按下图装置图连接好装置。通电一小段时间后,X极附近的现象是
另取少量上述胶体置于U型管中,按下图装置图连接好装置。通电一小段时间后,X极附近的现象是
(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
_____ ___。
(5)G的水溶液显 性(填酸或碱);原因是(用离子方程式表 示) 。
(6)J在H2O2分解反应中作催化剂。若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是 。
(7)上述①--⑤5个化学反应中属于置换反应的有 (填序号)
31、 (6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+
、AlO2-、SO42- 、SiO32-
、CO32-、Cl-中的某几种离子,现进行如下实验:
(6分)某强碱性溶液中可能含有的离子是K+、NH4+、Al 3+
、AlO2-、SO42- 、SiO32-
、CO32-、Cl-中的某几种离子,现进行如下实验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶液中肯定存在的离子是_______ ______,
肯定不存在的离子是_______ _________
(2)已知一定量的原溶液中加入5 mL 0.2 mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187 g,则原溶液中是否含有Cl-?_________________。
(3)按照反应顺序逐步书写出②中发生反应的离子反应方程式
① ②
③ ④
⑤
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com