
25. 将0.1
mol的镁.铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
将0.1
mol的镁.铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
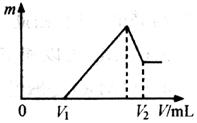
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。当V1=160mL时,则金属粉末中
n(Mg)=___________mol,V2=___________mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+.Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)___________mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:__________。
华中师大一附中2008-2009学年度第一学期期末检测
24.为了测定某光卤石(KCl·MgCl2·6H2O及少量NaCl杂质)样品中镁元素质量分数,课外小组设计如下方案:
方案Ⅰ:
①称取Wg样品,加适量水溶解,并配成500mL溶液;
②取25mL上述溶液,加入c1mol·L-1 NaOH溶液至沉淀不再增多为止,用去V1mL NaOH溶液;
③平行实验(即重复上述操作1-2次);
④计算。
方案Ⅱ:
①同方案Ⅰ中的(1);
②从配制的500mL的溶液中取25mL加入过量c1mol·L-1 NaOH溶液V1mL;
③加入2-3滴指示剂;
④用c2mol·L-1盐酸滴定至终点,用V2mL盐酸;
⑤平行实验2-3次;
⑥计算。
方案Ⅲ:
①同方案Ⅰ中的(1);
②加入过量Na2CO3溶液;
③过滤,将沉淀洗涤烘干后,称量为W1g;
④平行实验;
⑤计算。
(1)方案Ⅰ中计算镁元素的质量分数为__________。
(2)方案Ⅱ中:
a.指示剂应选用________________;滴定终点如何判断
b.若实验过程中消耗盐酸的体积记录数据为:V1=18.56mL,V2=18.64mL,V3=18.00mL则计算时所取用的盐酸的体积是 mL。
c.此方案的优点为 。
d.有下列操作引起镁质量分数偏大的是( )
①酸式滴定管用蒸馏水洗涤后,未用标准液润洗
②滴定前尖嘴有气泡,滴定后消失
③开始平视读数,滴定结束俯视读数
④开始俯视读数,滴定结束仰视读数
(3)方案III中:如何判断加入的Na2CO3溶液已过量?
(4)你认为上述各方案中,在正确操作的情况下,可能造成误差较大的方案为
23.(8分)已知硫酸的第一步电离(H2SO4=H++HSO4-)是完全的,但第二步电离(HSO4- H++SO42-)并不完全。如果25℃时,0.1mol/L H2SO4溶液中c(SO42-)=0.010mol/L,0.1mol/L NaHSO4溶液中c(SO42-)=0.029mol/L,试回答:
H++SO42-)并不完全。如果25℃时,0.1mol/L H2SO4溶液中c(SO42-)=0.010mol/L,0.1mol/L NaHSO4溶液中c(SO42-)=0.029mol/L,试回答:
(1)25℃时,0.1mol/L H2SO4溶液中pH= ;(可用对数表示)
(2)为何0.1mol/L的H2SO4溶液中c(SO42-)比0.1mol/L的NaHSO4溶液中c(SO42-)小?
(3)0.1mol/L Na2SO4溶液的pH值 7(填大于、小于或等于)
(4)常温下测得0.25mol/L的CuSO4溶液的pH值为5,0.25mol/L Cu(ClO4)2溶液的pH值为4.5,其原因是
22.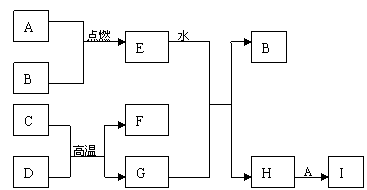 (8分)A~I均是中学化学常见的物质,A、B、C、G为单质,其余均为化合物。在相同条件下,气体A的密度是气体B的密度的35.5倍;C的合金广泛用于生活中,C元素在周期表中周期数等于主族族数。单质G广泛用于建筑材料,G的一种离子是血红蛋白的成分,该离子肩负输氧的重任。它们间的转化关系如下图所示:回答下列问题:
(8分)A~I均是中学化学常见的物质,A、B、C、G为单质,其余均为化合物。在相同条件下,气体A的密度是气体B的密度的35.5倍;C的合金广泛用于生活中,C元素在周期表中周期数等于主族族数。单质G广泛用于建筑材料,G的一种离子是血红蛋白的成分,该离子肩负输氧的重任。它们间的转化关系如下图所示:回答下列问题:
(1)G在周期表中的位置是: E的电子式为:
(2)C+D→F+G的化学方程式为:
(3)C溶于烧碱溶液的离子方程式为:
(4)I可以作为净水剂,原理是(用离子方程式表示):
21.(8分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ |
|
阴离子 |
OHˉ Clˉ CO32- SO42- HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们是A_ _ _;B__ __;C__ _ __;D_
20.0.1mol/L的NaOH溶液0.2L,通入448mL(标况下)H2S气体,所得溶液微粒浓度大小关系正确的是
A.c(Na+)>c(HS-)>c(OH-)>c(S2-)>c(H+)
B.c(Na+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
C.c(Na+)=c(H2S)+c(HS-)+c(S2-)+c(OH-)
D.c(S2-)+c(OH-)=c(H+)+c(H2S)
19.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是( )
A.电池工作时,锌失去电子,为负极,发生还原反应
B.电池正极的电极反应式为:2MnO2+H2O+2e-=Mn2O3+2OH-
C.电池工作时,电流由正极通过外电路流向负极
D.外电路中每通过约2×6.02×1023个电子,锌的质量理论上减小65g
18.少量下列物质中,不能通过化合反应得到的是( )
①FeS②Fe3O4③FeBr2④FeCl3⑤Fe(OH)3⑥Fe(OH)2 ⑦Mg3N2 ⑧Al2S3 ⑨CaC2(俗称电石)
A. ①③⑤ B. ③⑤⑥ C. ③⑤⑥⑨ D. ⑥⑨
17.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A.6g B.8g C.10g D.12g
16.含有ag HNO3的稀硝酸中,加入bg铁粉充分反应,铁全部溶解,生成NO,已知有a/4gHNO3被还原,则a︰b不可能的是
A 2︰1 B 3︰1 C 4︰1 D 9:2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com