
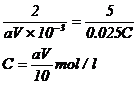
H
1mol 18xg
aV×10-3mol 0.025×Cmol
(3)无影 响。因当初所取的待测液的物质的量一定。
响。因当初所取的待测液的物质的量一定。
(4) 2KMnO4 ~ 5H2C2O4
2mol 5mol
(1)称25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为amol?L-1的KMnO4溶液滴定到KMnO4不再褪色为止,所发生的反应
2KMnO4+5H
试回答:(1)实验中不需要的仪器有(填序号)___________,还缺少的仪器有(填名称)___________________________________________________________________________。
a.托盘天平(带砝码,镊子)b.滴定管 c.100mL量筒 d.100mL容量瓶 e.烧杯
f.漏斗 g.锥形瓶 h.玻璃棒球 i.药匙 j.烧瓶
(2)实验中,标准液KMnO4溶液应装在_____________________式滴定管中,因为______________________________________________________________________。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,
则所测得的x值会__________________________(偏大、偏小、无影响)
(4)在滴定过程中若用amol?L-1的KMnO4溶液VmL,则所配制的草酸溶液的物质的
量浓度为________________________mol?L-1,由此可计算x的值是____________。
解析:该题涉及到气化还原滴定,虽然基于反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似。由于该反应有明显的颜色变化,故可不可用指示剂。
(1)c , f , j
还缺少铁架台(带滴定管夹),胶头滴管(定容时用)
(2)用酸式滴定管,因KMnO4溶液有强氧化性,能腐蚀橡皮管。
称取Wg草酸晶体,配成100.00mL水溶液
① 与②[H+]比值 。故选D。
。故选D。
例3:草酸晶体的组成可用H2C2O4?xH2O表示,为了测定x值,进行如下实验:
解析:①多一滴H2SO4[H+]=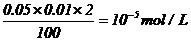
②少一滴即OH过量,[OH-]=10-5 mol/L.[H+]=10-9 mol/L
例2.用0.01 mol/L H2SO4滴定0.01mol/L NaOH溶液,中和后加水至100ml,若滴定时终点判断有误差:①多加1滴H2SO4;②少加1滴H2SO4;(设1滴为0.05ml)则①和②[H+]的比值是( )
A、10 B、
 PH=2
PH=2
∴选 D。
30y-10x  . A、B合适
. A、B合适
(2)加入y 20ml时,PH=2 代入
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com