
任何化学反应都涉及到快慢的问题,特别是化工生产中和实验室制备物质时,都要认真考虑反应进行的快慢及改变的方法如何,所以每年的高考都会出现本部分的题目。在命题中出现的题型主要是选择题,同一个问题可能从不同角度来考查;另外,除直接考查基本知识外,还增加了考查学生分析问题能力和应用知识能力的题目。考查的主要知识点有:①利用化学反应速率的数学表达式进行的有关计算;②反应中各物质反应速率之间的关系;③根据浓度、温度、压强、催化剂、颗粒大小、光等外界条件的改变,定性判断化学反应速率的变化。近几年的命题出现了通过化学反应速率测定的方法考查数学处理能力等趋势。考查考生对化学反应速率的理解,对化学反应速率表示方法的认识,以及运用化学方程式中各物质的化学计量比的关系进行有关的简单计算。
解题时应注意从对基本概念和基本规律的理解入手,要灵活、不能生搬硬套。如:
(1)从如下几个方面加深对反应速率概念的理解。①化学反应速率概念中单位时间内的变化值只能是浓度变化值,不是物质的量的变化值,因此在进行有关计算时,要同时注意反应物的体积,反应的时间和反应物物质的量的变化。②把化学反应速率的概念和化学方程式的意义联系起来,明确以下相等的比例关系。即在化学反应方程式中各物质前的化学计量数之比=各物质在反应中变化的物质的量之比=各物质在反应中变化的物质的量浓度之比=用各物质表示的该化学反应在一定时间内的平均反应速率之比。在具体计算中,要灵活应用上述关系式。既要会依化学方程式判断各物质表示的化学反应速率之间的关系是否正确,又要能由各物质在反应中的浓度变化值(或物质的量的变化值)写出反应的化学方程式,并会判断反应是否可逆。
(2)外界条件改变对化学反应速率的影响,要注意以下几点:①当正反应速率增大时,逆反应速率也必然随之增大,绝不可能一个增大另一个减小。②固体或纯液体量的改变不会引起其浓度改变,所以它的量的改变不会引起反应速率的变化。③对于没有气体参加的反应,压强改变,一般不会引起体积的变化,对浓度也没影响,所以压强改变不会影响其化学反应速率。压强对有气体参加的化学反应速率的影响,实质上是指对容器体积的改变,引起气体浓度的改变,从而影响反应速率,不要误认为只要体系压强增大,反应速率一定增大。
[例题](2001年全国理综,15)将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g)
2C(g)
若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
其中正确的是
A.①③ B.①④ C.②③ D.③④
解析:本题是考查物质浓度表示法,用不同反应物或产物表示反应的平均速率的方法和反应中转化率的计算等知识点,所以考查内容的知识容量较大。
解题时先利用所给条件列出反应式:
2A(g) + B(g) === 2C(g)
起始浓度 mol·L-1 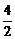 =2
=2 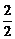 =1 0
=1 0
2 s时浓度 mol·L-1
2-0.6=1.4 1-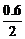 =0.7 0.6
=0.7 0.6
利用算出的数据,就可以对提问进行分析。
①依据反应的平均速率的定义可知

②同理可知

③依据转化率的定义可知

④2 s时B的浓度为0.7 mol·L-1
检查4个选项,只有①④正确,B项正确。
答案:B
2.反应速率受外界条件的影响发生变化的规律
(1)浓度:同一条件不变时,增加反应物的浓度,会加快反应速率。
(2)压强:在其他条件不变时,加大气体反应物的压强(实质上是增大反应物浓度),则反应速率加快;反之变慢。对于可逆反应,若反应物及生成物中均有气体,则增大压强,正逆反应速率均增大。
(3)温度:其他条件不变时,升高温度,化学反应速率一般增大。温度升高10℃,反应速率增至原来的2-4倍,因此,在可逆反应中,升高温度,正逆反应速率均增大。
(4)催化剂:在其他条件不变时,催化剂一般加快反应速率。在可逆反应中,能同等程度地改变正逆反应速率。在使用时要注意催化剂的活化温度及防止催化剂中毒。
(5)其他因素:如光、激光、超声波、放射线、电磁波、反应物颗粒大小等均可影响反应速率。
1.化学反应速率的计算与判断规律
(1)化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。计算公式为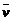 =Δc/t,单位为mol/L·min或mol/L·s。
=Δc/t,单位为mol/L·min或mol/L·s。
同一个化学反应mA+nB===pC,同一段时间内,用不同物质的浓度变化表示的反应速率,数值可能不同,但是意义相同。其数值之比等于方程式中有关物质的化学计量数之比,即vA∶vB∶vC=m∶n∶p
12.答案:(1)2 5 === 3 2 1 1 (说明:错一个即不给分)

(2)开始阶段由于HSO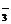 被氧化生成H+和SO
被氧化生成H+和SO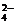 ,酸性加强,反应速度增大
,酸性加强,反应速度增大
解析:(1)考查氧化还原方程式的配平;(2)考查影响化学反应速率的外界条件。
由题意,速率加快的原因不可能是:①压强增大;②温度升高;③催化剂的使用;④反应物HSO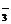 、IO
、IO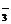 浓度增大。只能是由于5HSO
浓度增大。只能是由于5HSO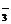 +2IO
+2IO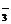 ===5SO
===5SO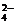 +I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
+I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
●命题趋向与应试策略
11.答案:(1)0.013 (2)1.0 催化剂 (3)> > (4)吸热 温度升高时,平衡向右移动
解析:(1)vA=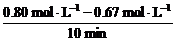 =0.013 mol·(L·min)-1
=0.013 mol·(L·min)-1
(2)对比实验1与实验2可知,反应温度相同,达平衡时的A的浓度相同,说明是同一平衡状态,即c2=1.0 mol·L-1,又因实际反应的速率快,达平衡所需时间短,说明反应中使用了催化剂。
(3)对比实验3与实验1可知,从10 min到20 min,实验1的A的浓度变化值为0.13 mol·L-1,而实验3的A的浓度变化值为0.17 mol·L-1,这就说明了v3>v1。又知从0 min到10 min A的浓度的变化值应大于0.17 mol·L-1,即c3>(0.92+0.17)mol·L-1=1.09 mol·L-1。
(4)对比实验4与实验1可知,两实验的起始浓度相同,反应温度不同,达平衡时实验4的A的浓度小,说明了实验4 A进行的程度大,即温度越高,A的转化率越大,说明正反应为吸热反应。
10.答案:(1)B C (2)D A
解析:此题以化学平衡知识为载体,考查了考生思维的有序性和严密性。解此题时首先要审清在题给条件下,只有S是固态,其余的物质都是气态。
容积固定的条件下,只有反应A在反应前后气体密度发生了变化。B反应后气体分子数减少,p前>p后;C反应前后气体分子数不变,即p前=p后。?
在压强不变,容积可变的条件下,反应A的产物只有水,密度必然减少,反应B的分子数减少,反应后密度必然增大,反应C的密度不发生改变,反应D的分子数增多,反应后密度必然减少。
9.答案:CD
解析:反应的平均速率是指单位时间内某物质浓度的变化量。已知容器体积为5 L,时间半分钟即30 s,NO的物质的量(变化量)为0.3 mol,则c(NO)=0.3 mol/5 L=0.06 mol·L-1。
所以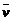 (NO)=0.06 mol·L-1/30 s=0.002
mol·L-1·s-1。即可求出:
(NO)=0.06 mol·L-1/30 s=0.002
mol·L-1·s-1。即可求出:
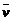 (O2)=0.002 mol·L-1·s-1×
(O2)=0.002 mol·L-1·s-1×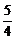 =0.0025 mol·L-1·s-1;
=0.0025 mol·L-1·s-1;
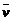 (H2O)=0.002 mol·L-1·s-1×
(H2O)=0.002 mol·L-1·s-1×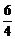 =0.003 mol·L-1·s-1;
=0.003 mol·L-1·s-1;
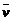 (NH3)=0.002 mol·L-1·s-1×
(NH3)=0.002 mol·L-1·s-1×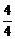 =0.002 mol·L-1·s-1。
=0.002 mol·L-1·s-1。
8.答案:A
7.答案:B
解析:在可逆反应中使用催化剂,能同等倍数改变正、逆化学反应速率,但不能改变反应的程度(指反应物的转化率或产率,或达到平衡时某物质在反应混合物中的含量),对照选项只有B项符合。
6.答案:A
解析:对于化学反应的速率,当温度升高时,反应速率增大,故选A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com