
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)
__________________________________________________________________。
20.(11分)
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
 |
回答下列问题:
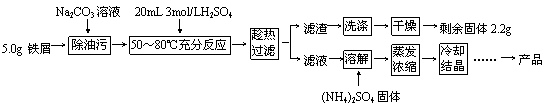
(1)Na2CO3溶液可以除油污,原因是(用离子方程式表示)_______________________。
(2)判断铁屑与硫酸基本反应完全的现象是_____________________________________。
(3)某同学认为铁屑与硫酸反应不需精确温度,因此不使用热水浴加热,改用酒精灯断断续续加热维持温度,该做法的不妥之处是__________________________________________。
(4)“趁热过滤”后的滤液有时略显黄色,分析其原因是(用离子方程式表示)_______________________________________。
(5)忽略油污质量,本实验中应称量(NH4)2SO4固体的质量为_______g。
(6)若上述流程用于大量生产,“冷却结晶”后的母液最佳处理方法是_______________。
19.(11分)
硫酸亚铁铵晶体[(NH4)2Fe(SO4)2?6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂,其实验室制备流程如下:
D.低温蒸干溶液,所得固体的质量为:原溶液中NaOH的质量 + 4.4g
A.增重的4.4g为参加反应的CO2的质量
B.溶质为Na2CO3
C.溶质为Na2CO3、NaHCO3
18、向0.50 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重4.4g,下列说法正确的是
C.该醋酸溶液的物质的量浓度大于0.01 mol?L-1
D.混合溶液中:c(CH3COO-) > c(Na+)
B.该醋酸溶液中:c(H+) = 0.01 mol?L-1
17、某醋酸溶液与0.01 mol?L-1 NaOH溶液等体积混合(忽略溶液体积变化),混合后溶液显碱性。下列有关叙述不可能出现的是
A.混合后溶液中:c(CH3COO-) + c(OH-) = c(Na+) + c(H+)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com