
5.若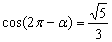 且
且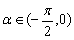 ),则
),则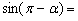 ( )
( )
(A)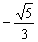 (B)
(B)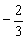 (C)
(C)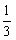 (D)
(D)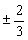
4.下列结论中,错用基本不等式做依据的是( )
(A)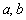 均为负数,则
均为负数,则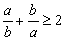 (B)
(B) 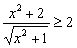
(C)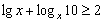 (D)
(D)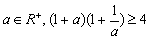
3.长方体的长、宽、高分别为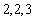 ,若该长方体的各顶点都在球
,若该长方体的各顶点都在球 的表面上,则球
的表面上,则球 的表面
的表面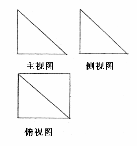 积为( )
积为( )
(A)7 (B)14 (C)17 (D)56
2.已知等差数列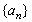 中,
中,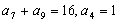 ,则
,则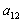 的值是( )
的值是( )
(A)15 (B)30 (C)31 (D)64
1.若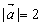 ,
,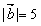 ,
, 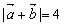 ,则
,则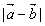 的值为( )
的值为( )
(A) (B)3 (C) (D)7
32、(12分)以黄铁矿为原料生产硫酸的工艺流程图如下:
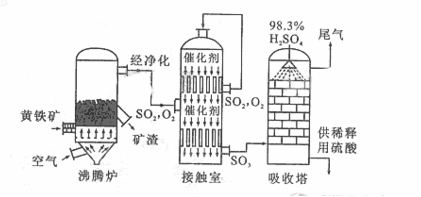
(1)接触室中发生反应的化学方程式是 。
(2)依据工艺流程图判断下列说法正确的是 (选填序号字母)。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(3)每160g SO3气体与H2O化合放出260.6kJ的热量,该反应的热化学方程是 。
(4)吸收塔排出的尾气先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
①SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中Br2。SO2吸收Br2的离子方程式是 。
②为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:铵盐质量为10.00g和20.00g时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
计算:该铵盐中氮元素的质量分数是 %;若铵盐质量为15.00g。浓硫酸增加的质量为 。(计算结果保留两位小数)
31、(10分)某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。
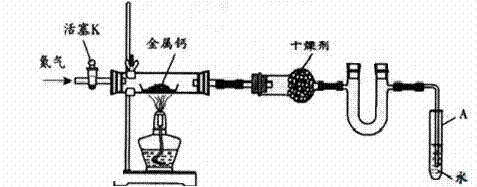
(1)按图连接好实验装置。检查装置的气密性,方法是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
|
空瓷舟质量 m0/g |
瓷舟与钙的质量 m1/g |
瓷舟与产物的质量 m2/g |
|
14.80 |
15.08 |
15.15 |
① 计算得到实验式CaxN2, 其中x= .
② 若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。
30.(10分) 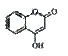 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
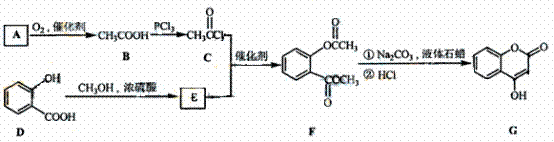
(1)A与银氨溶液反应有银镜生成,则A的结构简式是 。
(2)B→C的反应类型是 。
(3)E的结构简式是
(4)写出F和过量NaOH溶液共热时反应的化学方程式:
(5)下列关于G的说法正确的是
a.能与溴单质反应 b. 能与金属钠反应
c. 1molG最多能和3mol氢气反应 d. 分子式是C9H6O3
29、(12分)C和Si元素在化学中占有极其重要的地位。
(1)写出Si的基态原子核外电子排布式 。
从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为 。
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为 ,微粒间存在的作用力是 。
(3)氧化物MO的电子总数与SiC的相等,则M为 (填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl晶体相似。MO的熔点比CaO的高,其原因是 。
28.迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是
A.迷迭香酸属于芳香烃
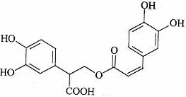 B.1mol迷迭香酸最多能和9mol氢气发生加成反应
B.1mol迷迭香酸最多能和9mol氢气发生加成反应
C.迷迭香酸可以发生水解反应、取代反应和酯化反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
第Ⅱ卷(非选择题 共44分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com