
23、某温度下的溶液中c (H+)=1.0×10x mol/L,c (OH-)=1.0×10y mol/L。x与y的关系如右图所示;
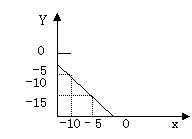 (1)求该温度下,中性溶液的pH。
(1)求该温度下,中性溶液的pH。
(2)求该温度下0.01mol/LnaOH溶液的PH
(3)该温度下,pH=a的醋酸溶液与pH=b的NaOH溶液等体积混合,恰好完全反应,
求此醋酸溶液中醋酸的电离度。
22、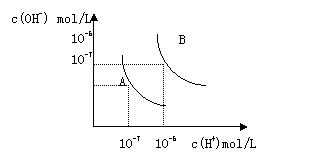 水的电离平衡曲线如图所示。
水的电离平衡曲线如图所示。
(1) 若以A点表示25℃时水的电离平衡的离子
浓度,当温度升高到100℃时,水的电离平衡状
态移动到B点,则此时水的离子积
从________变化到_________。
(2) 将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混
合,并保持100℃的恒温,致使混合溶液
的pH=7,则Ba(OH)2和盐酸的体积比为__________________。
(3) 已知AnBm的离子积为[c(Am+)]n[c(Bn-)]m,若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,其离子积约为______________。
三 计算题
21.测得某溶液的pH = 6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈_____性。测定温度______室温(填高于、低于或等于),其理由是 。 将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合。
(1)若所得混合液为中性,则a︰b 。
(2)若所得混合液的pH=2,则a︰b 。
20、常温下某溶液,水电离出的c (OH-)=1.0×10-4 mol/L,该溶液中溶质可能是 ( )
①Al2(SO4)3 ②NaOH ③NH4Cl ④NaHSO4
A、①② B、①③ C、②③ D、①④
二 填空题
19.NaH是-种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是 ( )
A 跟水反应时,水作氧化剂 B NaH中H-半径比Li+半径小
C 跟液氨反应时,有NaNH2生成 D 跟乙醇反应时,NaH被氧化
18. 有下列四种溶液:(1)HCl (2)AlCl3(3)NaOH (4)Na2CO3,此四种溶液中水的电离度分别为a1、a2、a3、a4已知a1=a3,a2=a4且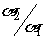 =106,则四种溶液的PH值不可能是 ( )
=106,则四种溶液的PH值不可能是 ( )
A、5 5 10 10 B、4 4 10 10
C、3 5 11 9 D、5 3 9 11
17.a、b、c、d四种溶液PH值都小于7,已知四种溶液中[H+]和[OH-]之和由大到小的顺序是b>a>d>c,则这四种溶液PH值由大到小的顺序是 ( ) A.c>d>a>b B.b>a>d>c C.a>b>c>d D.无法确定
16.4体积pH=9的Ca(OH)2溶液跟1体积pH=13的NaOH溶液混合后,溶液中氢离子浓度为 ( )
A.5×10-13mol/L B.2×10-12mol/L
C.1/5(4×10-9 + 1×10-13)mol/L D.1/5(4×10-5 + 1×10-1)mol/L
15.能表示人体大量喝水时,胃液的pH变化的是 ( )

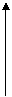
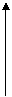
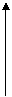 pH
pH
pH
pH
pH
pH
pH
pH






 7 7
7
7
7 7
7
7



 0
V(H2O) 0
V(H2O) 0 V(H2O)
0
V(H2O)
0
V(H2O) 0
V(H2O) 0 V(H2O)
0
V(H2O)
A B C D
14.已知NaHSO4在水中的电离方程式为NaHSO4 =Na+ +H+ + SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液pH为2,对于该溶液,下列叙述不正确的是 )
A、该温度高于25℃
B、水电离出来的c (H+)=1.0×10-10 mol/L
C、c (H+)= c (OH-)+C(SO42-)
D、该温度下加入等体积pH值为12的NaOH溶液可使反应后的溶液恰好呈中性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com