
4、烷烃卤代反应机理:自由基取代(SR)
链引发:
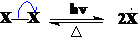
自由基从无到有,浓度从小到大,当自由基的浓度增大到一定程度,反应进入链增长阶段。
链增长:
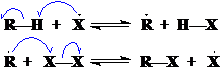
自由基浓度不变,RX和HX浓度增大,RH和X2浓度减小,当RH和X2的浓度减小到一定程度时,反应进入链终止阶段。
链终止:
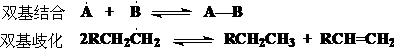
自由基的浓度通过双基歧化和双基结合迅速降低,当自由基的浓度下降到一定程度时,反应停止。
自由基反应的引发方式:
物理引发:加热、光照、辐射、激光、超声波等。
化学引发:引发剂-受热容易生成自由基的化学物质,常用的引发剂有:过氧化二苯
甲酰、偶氮二异丁腈。
⑵影响反应活性的因素:
卤素:(F) > Cl > Br > (I)
RH: a-H>叔-H>仲-H >伯-H > CH4
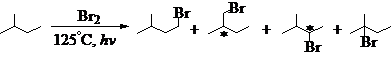
1´3 1´6 81´2 1600´1
3、热解:
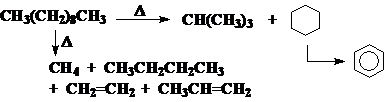
2、卤代:只涉及C-H单键
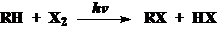
1、燃烧:C-C和C-H键都涉及(要求配平!)
结构、性质和应用
有机化合物的性质包括:物理性质、化学性质、波谱性质、生物学性质等,其中最重要的是化学性质。
有机化合物的化学性质可以分为通性和特性;通性与是由官能团所决定的性质,而特性则与分子整体相关;学习通性要与官能团相联系,特性则主要靠记忆。
2、空间效应
⑴空间效应和分子的内能
任何空间上的拥挤,都会导致分子的内能升高。
要特别注意:原子和原子团之间的排斥作用,来源于它们周围运动的电子之间的斥力,因此原子和原子团的空间体积,远远大于我们的想象。
①同面同向原则:1,3-斥力
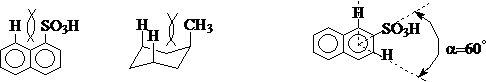
存在斥力 存在斥力 没有斥力
②同面、相邻、同侧、较大原则:
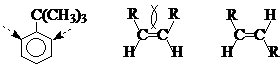
③苯环上两个间位取代基对中间位置有空间屏蔽作用
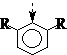
④叔丁基的巨大空间效应
在苯环上可以屏蔽邻位,在六元环上只能占据平伏键-冻结构象
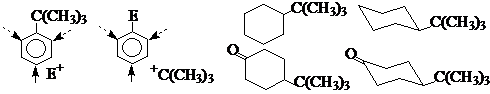
⑵空间效应对反应的影响
空间宽敞的方向有利于分子相互接近,形成能量较低的过渡态,生成主要产物;相反,空间拥挤的方向阻碍分子的相互接近,形成的过渡态能量较高,只能生成次要产物。一般情况下,反应的选择性是空间效应的结果。尤其当反应中心周围的原子或原子团较大,或者试剂的体积较大时,空间效应表现得更加明显。例如:
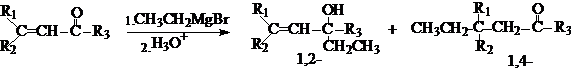
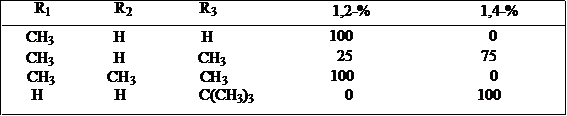
应当注意,空间效应对反应方向或选择性的影响,发生在形成过渡态之前,而不是体现在中间体或产物上,所以在很多情况下,空间效应可能导致生成内能比较高的产物。如:
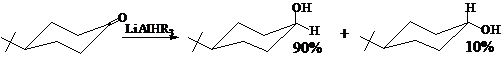
顺式(a、e):内能较高 反式(e、e)内能较低
在合成中如果能巧妙地利用空间效应,可以从根本上改变反应收率,甚至改变反应产物的主次关系。如:a-甲基环己酮直接甲基化,选择性很差,生成多种产物的混合物,没有合成价值:
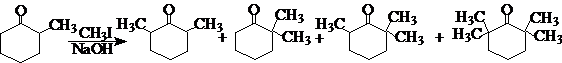
利用体积较大的环状仲胺导入空间效应,则可以得到90%的 a,a’-二甲基环己酮:
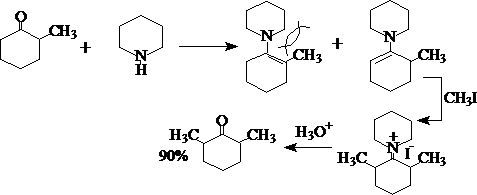
3、超共轭效应
超共轭效应的起因:

为什么?需要从理论上做出解释-提出了超共轭效应这种假设或理论。
超共轭效应认为:
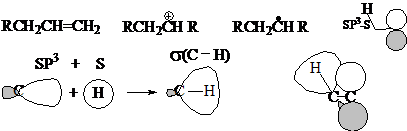
超共轭效应的特点:
(1)是一种非平行重迭形成的电子离域作用,由于轨道之间重迭程度很小,所以与共轭效应相比,它属于弱电子效应,但它对体系的影响仍然强于诱导效应。因此,三种电子效应的强度:共轭 > 超共轭 > 诱导。
(2)由于C-C可以自由转动,所以只有当C-H键转到与P轨道共平面时,才能实现瞬间的重迭。因此可以想到:相邻的C-H键越多,C-C单键转动时,重迭的几率越大,超共轭效应越强,也就是说:超共轭效应越强与相邻的C-H键数目成正比。
(3)超共轭效应体现的方式与共轭效应相似,只是影响程度较小而已。
超共轭效应的应用:
碳正离子和碳自由基的内能:
注意:①共轭 > 超共轭 > 诱导;②烷基越大,+I效应越强!
下列是常见的碳正离子:
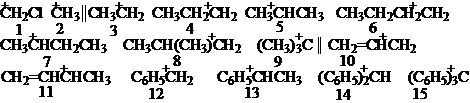
它们的内能从低到高排列顺序如下:
15 < 14 < 13 < 12 < 11 < 10 < 9 < 5 < 7 < 3 < 6 < 4 < 8 < 2 < 1
影响自由基的因素于碳正离子相同,所以自由基的内能顺序与上述相同。
(4)碳负离子:
烷基碳负离子:中心碳SP3杂化,不存在共轭和超共轭效应,只有诱导效应对其内能产生影响:+I导致内能上升,-I导致内能下降:
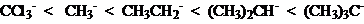
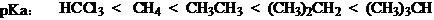
a-碳负离子:C=C-C – 和 O=C-C -,中心碳SP2杂化,存在共轭、超共轭效应,诱导效应则成为次要因素。
2、共轭效应(±C)
凡是共轭体系,都具有共轭效应。因此识别共轭体系,是掌握共轭效应的首要任务。
共轭体系分为p-p和p-p共轭体系两种:
p-p 单双交替: C=C-C=C、C=C-C=O、C=C-C=N…
p-p 大p键pmn :缺电子n < m C=C-C+;正常 n = m C=C-C·;富电子n > m C=C-C- or C=C-Z:
共轭效应:凡是共轭体系,都存在共轭效应。共轭效应体现在以下几个方面:
(1)内能下降,而且共轭体系越大,内能下降得越多。理论上讲,无限大的共轭体系,内能下降得最多。无限大的链状共轭体系是不存在的,但闭合的共轭体系(无头无尾,如苯环),相当于无限大的共轭体系,内能下降的最大,所以苯的共振能高达150.4kJ/mol。
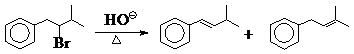 共轭效应导致内能下降,对制约反应方向起到关键作用,从热力学上可以预测到:如果一个反应途径可以导致生成共轭体系,那么这个途径肯定生成主要产物(平衡体系、热力学产物),如消除反应的共轭优先规则。
共轭效应导致内能下降,对制约反应方向起到关键作用,从热力学上可以预测到:如果一个反应途径可以导致生成共轭体系,那么这个途径肯定生成主要产物(平衡体系、热力学产物),如消除反应的共轭优先规则。
主 次
不符合查依采夫规则 符合查氏规则
当然,共轭效应对判断体系(包括分子、中间体、过渡态)的内能高低、稳定性大小,总是起着主导作用。
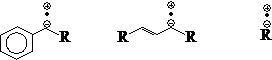
内能 低 中 高
稳定性 大 中 低
(2)平均化:共轭体系的电子云密度和键长发生平均化,而且共轭体系越大,平均化程度越大。从理论上预测,无限大的共轭体系必然发生绝对平均化。如苯分子:电子云和键长都完全平均化-平面正六边形。
平均化导致共轭体系中电子云密度的变化,变化就有方向问题,共轭效应的正负(±C)则表明电子云密度变化的方向。

OH对于苯环为+C CH2+对于苯环为-C
苯环对于OH为-C 苯环对于CH2+为+C
(3)p或p电子的活性增大:共轭体系导致电子的运动范围扩大,受原子核的束缚力减小,因此容易发生转移(另一种说法:电子云容易变形),导致化学活性增大。
5、电子云密度与碱性:
碱性 气相:(CH3)3N > (CH3)2NH > CH3NH2 > NH3 > C6H5NH2 电子效应(-I)
液相: (CH3)2NH > CH3NH2 > (CH3)3N > NH3 > C6H5NH2 溶剂化效应
4、碳负离子的内能与酸性:

CH4 CH3CH3 (CH3)CH2 (CH3)3CH
pka 40 42 45 /
HCOOH CH3COOH (CH3)2CHCOOH (CH3)3CCOOH
pka 3.75 4.76 4.86 5.05
CH3COOH CH2ClCOOH CHCl2COOH CCl3COOH
pka 4.76 2.81 1.29 0.08
负离子的内能:甲基 < 伯 < 仲 < 叔
三氯乙酸根 < 二氯乙酸根 < 氯乙酸根
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com