电解 D.用惰性电极电解MgCl2溶液:2Cl-+2H2O H2↑+Cl2↑+2OH-
试题详情
8.在下列物质的溶液中分别加入一定量的Na2O2固体,不会出现浑浊现象的是( ) A.饱和溶液Na2CO3溶液
B.Ca(HCO3)2稀溶液 C.Na2SO3稀溶液
D.饱和CaCl2溶液 试题详情
 9.要证明某种盐的水解反应是吸热的,有四位同学设计实验如下,其中不正确的是( ) 9.要证明某种盐的水解反应是吸热的,有四位同学设计实验如下,其中不正确的是( )
A.甲同学:通过实验发现相同浓度的热的纯碱溶液比冷的纯碱溶液去污效果好,说明碳酸钠水解是吸热的 B.乙同学:加热混有Fe3+的KNO3溶液能使Fe3+沉淀为Fe(OH)3,从而将Fe3+除去,说明含Fe3+的盐水解是吸热的 C.丙同学:在醋酸钠溶液中滴入酚酞溶液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的 D.丁同学:将硝酸钠晶体溶于水,水温下降,说明硝酸钠水解是吸热的 试题详情
10.将40℃的饱和硫酸铜溶液升温至50℃,或者温度仍保持在40℃而加入少量无水硫酸铜, 在这两种情况下均保持不变的是( ) A.硫酸铜的溶解度 B.溶液中溶质的质量分数 C.溶液的质量
D.溶液Cu2+中的数目 试题详情
11.由主族元素构成的某离子化合物中,一个阳离子和一个阴离子核外电子数之和为20。下列说法中正确的是( ) A.晶体中阳离子和阴离子个数一定相等 B.晶体中一定有离子键可能有共价键 C.所含元素一定不在同一主族 D.晶体中阳离子半径一定大于阴离子半径 试题详情
12.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出,该溶液可能大量存在的一组离子是 ( ) 试题详情
试题详情
13.从下列事实所得出的相应结论正确的是( ) 实验事实 结论 A 常温下白磷可自燃,而氮气要在放电条件下才与氧气反应 非金属性:P>N B CO2的水溶液可导电 CO2是电解质 C SO2通入溴水溶液,溶液褪色 SO2有漂白性 D NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 同浓度的pH:NaAlO2> NaHCO3 试题详情
14.一定量某浓度的硝酸与过量铁粉反应时生成N2O气体,消耗0.8 mol Fe。若改与铝反应 (生成N2O气体),则最后可溶解的铝的质量是( ) 试题详情
A.13.5 g B.121.6 g C.14.4 g D.18.9 g 试题详情
试题详情
A.硫氢化钠的水解:HS- + H2O
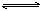 H3O+ + S2- H3O+ + S2- B.小苏打溶液中滴加醋酸溶液:HCO3-
+ CH3COOH == CH3COO- + H2O + CO2↑ C.氯碱工业目前采用的比较先进的设备――离子交换膜电解槽中,阳极发生的反应是:4OH- - 4e- == O2↑+ 2H2O 试题详情
试题详情
CH4(g)+ 2O2(g)== 2H2O(g)+ CO2(g);ΔH=-802.3kJ/mol 试题详情
16.固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是(
) 试题详情

A.有O2参加反应的a极为电池的负极 B.b极的电极反应为:H2 - 2e- =2H+ C.a极的电极反应为:O2 + 2H2O + 4e- = 4OH- 试题详情
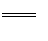 D.电池的总反应式为:2H2
+ O2 D.电池的总反应式为:2H2
+ O2  2H2O 2H2O
试题详情
17.将一元酸HA溶液与一元碱BOH溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是( ) A.若混合前酸、碱pH之和等于14,则HA肯定是弱酸 B.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸 C.溶液中水的电离程度:混合溶液>纯水>BOH溶液 D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-) 试题详情
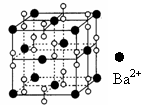 18.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法不正确的是( ) 18.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法不正确的是( )
A.该晶体属于离子晶体 B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与NaCl相似 D.与每个Ba2+距离相等且最近的Ba2+共有12个 试题详情
19.某同学用Na2CO3配制0.10mol?L-1Na2CO3溶液的过程如下图所示:你认为该同学的错误有( ) 试题详情

A.1处
B.2处 C.3处 D.4处 试题详情
20. 某温度下,密闭容器中,发生如下可逆反应:2E(g) F(g)+ xG(g);△H<0。若起始时E的浓度为amol/L,F、G的浓度均为0,达到平衡时E的浓度为0.5amol/L;若E的起始浓度改为2amol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( ) F(g)+ xG(g);△H<0。若起始时E的浓度为amol/L,F、G的浓度均为0,达到平衡时E的浓度为0.5amol/L;若E的起始浓度改为2amol/L,F、G浓度仍为0,当达到新的平衡时,下列说法正确的是( ) A.升高温度时,正反应速率加快,逆反应速率减慢 B.若x=1,容器体积保持不变,新平衡下E的体积分数为50% 试题详情
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol/L D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol 试题详情
 卷Ⅱ(非选择题,共45分) 卷Ⅱ(非选择题,共45分)
试题详情
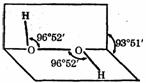
三、本大题有5小题。 21.(共7分)过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与 O-O键之间的空间夹角约为97° (1)H2O2的电子式为 ▲ ,其分子属于 ▲ (填:“极性”或“非极性”)分子。 (2)经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式 ▲
双氧水中加入过量的Ba(OH)2溶液,其反应的离子方程式是
▲
。 (3)H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为
▲ ,并标出电子转移的方向与数目 ▲ 。 (4)为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3?3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选) ▲ 。 A . MnO2 B. H2S C. 稀H2SO4 D NaHCO3 试题详情
22.(共7分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g?mol ? 1,甲元素的原子最外层电子数与K层电子数相等,E的水溶液显碱性,F是一种不溶于水的白色固体,K为乙元素的单质。C为单质,其原子在周期表中半径最小。D为气体,对空气的相对密度为1.103。在适当的条件下,它们相互之间有如下图所示的转化关系: 试题详情

试填写下列空白: (1)甲元素的单质在空气中燃烧时除得到A外,还可得到 ▲ ,所得固体中加入足量盐酸充分反应后,取部分溶液蒸干灼烧后所得固体为 ▲ 。 (2)B呈固态时的密度比液态时的密度 ▲ (填“大”或“小”),主要的原因是
▲
。 (3)“E + D→G + B”的化学方程式为:
▲
。 “E + CuO”的化学方程式为:
▲
。 试题详情
23.(共9分)⑴高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3g NaHCO3、0.3g Na2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3、Na2CO3同时倒入试管中,观察到现象如下: ①试管中(填产生沉淀或气体及反应速率等相关现象)
▲
。 ②两试管中气球大小(包含试管) 体积之比约为(填最简单整数比)(酸均足量) ▲ 。 ③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义): HCO3-(aq)+ H+(aq)
=H2O(l)+ CO2(g) ;△H>0 CO32-(aq)+ 2H+(aq)=
H2O(l) + CO2(g) ;△H<0 甲下结论的方法是否正确 ▲
(填“正确”或“不正确”) ⑵ 为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做3次平行实验,取平均值): 序号 试剂1 试剂2 混合前温度 混合后最高或最低温度 ① 50mL水 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
含3.2g Na2CO3的饱和溶液15ml水 20℃ 试题详情
试题详情
试题详情
试题详情
试题详情
23.5℃ 请你帮助填写相关内容: ①该研究报告的题目是《
▲
》; ②该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 ▲ 和 ▲ ;通过上述实验可得出多条结论,如: a:NaHCO3的溶解是 ▲ (吸热或放热)过程; b:Na2CO3的饱和溶液和盐酸的反应是 ▲ (吸热或放热)反应; c:NaHCO3固体与稀盐酸反应的反应热约是 ▲ 的热效应之和。 试题详情
24.(共14分)Fe是地壳中含量很丰富的元素,也是生物体所必须的元素。 (1)
我国南方某些地区的井水取来久置后,井水由澄清变成少量红棕色絮状沉淀积于缸底,水面浮着一层“锈皮”。这层“锈皮”的主要成分是(写化学式) ▲ 。 (2)
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
▲ ; A.4Fe(OH)2 + 2H2O + O2 ==
4Fe(OH)3 B.2Fe + 2H2O + O2
== 2Fe(OH)2 C.2H2O
+ O2 + 4e- == 4OH-
D.Fe ? 3e-
== Fe3+ (3)
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3+ + SO32- + H2O ==
2Fe2+ + SO42- + 2H+;二是发生双水解反应:2Fe3+ +3SO32-
+6H2O == 2Fe(OH)3(胶体) + 3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白: ①实验Ⅰ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液的颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是 ▲ 。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是 ▲ 。将溶液分成两等份,其中一份加入KSCN溶液,溶液变为血红色,反应的离子方程式为
▲
。另一份中加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式 ▲ 。 ②实验Ⅱ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅰ,产生的现象完全相同。由上述实验得出的结论是
▲
。 ③若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是
▲
。 ④从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是: Ⅰ.
▲
; Ⅱ.
▲
; (4)
自然界中铁矿石主要有赤铁矿和磁铁矿,应用高炉能冶炼制得金属铁。Fe3O4在高炉中有下列反应:Fe3O4 + CO→ 3FeO + CO2 反应形成的固体混合物(FeO、Fe3O4)中,元素氧和铁的质量比用mO:mFe表示。设Fe3O4被CO还原的质量分数为x,则x和混合物中mO:mFe的关系式(用含mO、mFe的代数式表示)。x=
▲
。 试题详情
25.(共8分)某校化学小组学生进行“气体相对分子质量的测定”的实验。操作如下:用质量和容积相等的烧瓶收集气体,称量收集满气体的烧瓶质量。数据见下表(已换算成标准状况下的数值)。 气体 A B C D E F 烧瓶和气体的总质量(g) 试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
试题详情
已知标准状况下,烧瓶的容积为0.293L,烧瓶和空气的总质量是48.4212g。空气的平均相对分子质量为29。A、B、C、D、E、F是中学常见的气体。 (1)上述六种气体中,能够使品红溶液褪色的是 ▲ (写化学式) (2)E的相对分子质量是 ▲ 。 (3)实验室制取少量D的化学方程式是 ▲ 。 (4)A、B、C可能的化学式是 ▲ 。 2006学年浙江省五校联考(一) 化学答题卷 试题 一 二 三 总分 21 22 23 24 25 得分
卷Ⅰ(选择题,共55分) 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 试题详情
二、选择题:本大题有15小题,每小题3分,共45分。  卷Ⅱ(非选择题,共45分) 卷Ⅱ(非选择题,共45分)
试题详情
21.(1)电子式为
,属于
(填:“极性”或“非极性”)分子。 (2)
第一步的电离方程式 反应的离子方程式是
。 (3)离子方程式为
,并标出电子转移的方向与数目 (4)能使过碳酸钠较快失效的物质是(多选)
试题详情
22. (1)还可得到 ,充分反应后,蒸干灼烧后所得固体为
。 (2)
(填“大”或“小”), 主要的原因是
。 (3)“E + D→G + B”的化学方程式为:
。 “E + CuO”的化学方程式为:
。 试题详情
23.⑴①试管中(填产生沉淀或气体及反应速率等相关现象)
。 ②体积之比约为(填最简单整数比) ;③ (填“正确”或“不正确”) 试题详情
 ⑵①题目是《
》; ⑵①题目是《
》;
②仪器名称为 和 ; a:是 (吸热或放热)过程; b:是 (吸热或放热)反应; c:约是
的热效应之和。 试题详情
24.(1)化学式
。 (2)不发生的化学反应是
; (3) ①这种红褐色液体是
。 可以观察到的现象是
反应的离子方程式为
,
。 ②结论是
。 ③该反应的化学方程式是
。 ④其原因可能是: Ⅰ.
; Ⅱ.
; (4) x=
。 试题详情
25.(1) (写化学式) (2)E的相对分子质量是 。 (3)实验室制取少量D的化学方程式是 。 (4)可能的化学式是A 、B 、C
。 2006学年浙江省五校联考 试题详情
1.D 2.C 3.D 4.B 5.B 6.D 7.C 8.C 9.D 10.B 11.B
12.D 13.D 14.C 15.B 16.D 17.A 18.B 19.D 20.B 21(共7分).(1)略 (1分)
极性 (1分) (2) H2O2 H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分) H++HO2- (1分)
H2O2+2OH-=O22-+2H2O(1分) (3)H2O2+SO2=2H++SO42-(2分) (4)ABC(1分) 22(共7分).(1)MgO 、C (1分)
MgO(1分) (2)小(1分), 在液态水中,几个水分子间存在氢键,在冰中,水分子大范围地以氢键相互 联结,形成相当疏松的晶体,使体积膨胀,密度减小。(1分) (3) 4NH3+5O2=4NO+6H2O (1分) 2NH3 + 3CuO 3Cu + 3H2O + N2(2分) 3Cu + 3H2O + N2(2分) 23.(共9分)(1)①两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多(1分) ②约为53/42;(1分) ③不正确 (1分) ⑵ ①《NaHCO3、Na2CO3
和盐酸反应过程中热效应的研究》(1分) ②托盘天平(1分)、温度计;(1分) a吸热(1分) b:放热 (1分) c:NaHCO3溶解和NaHCO3与盐酸反应(1分) 24.(共14分)(1)Fe2O3 (1分) (2)D(1分) (3)①氢氧化铁胶体,(1分)先产生红褐色沉淀,后沉淀逐渐溶解,溶液变成黄色且有气泡产生(1分)Fe3+ + 3SCN-
== Fe(SCN)3 (1分) Ba2+
+ SO42- == BaSO4↓(1分) ②Fe3+与SO32-同时发生氧化还原反应和双水解反应(2分) ③2Fe3+ + 3CO32-
+ 3H2O == 2Fe(OH)3↓+ 3CO2↑(2分) ④SO32-有较强的还原性,CO32-没有还原性(1分);SO32-水解能力较CO32-小(1分) (4)4-21mO  2mFe
(2分) 2mFe
(2分)
25.(共8分)(1)so2(1分) (2)30(2分)
(3)CaC2+2H2O→Ca(OH)2+C2H2(2分) (4)N2\CO\C2H4(各1分)
| 
 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)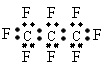 A.C
A.C