
题目列表(包括答案和解析)
3.下列反应从氧化还原角度看,与其他三个不同的是( )
A.Cl2 + H2O = HCl + HClO
B.BrCl +H2O = HCl +HBrO
C.2Na2O2 + 2H2O = 4NaOH + O2↑
D.2F2 + 2H2O = 4HF + O2
2.下列说法正确的是( )
A.NA个H2SO4 分子的总质量就是H2SO4的摩尔质量
B.将40g烧碱溶于水得溶液甲,再向甲中通入l molHCl得溶液乙(假设过程中溶液体
体积不变),则在相同温度下。甲和乙的导电能力一样
C.1L0.1 mol/L。HF溶液中含有的离子总数约为0.2 NA
D.标况下 22.4L SO2 溶解于水并稀释为1 L后,溶液中c(H+)=2 mol/L
2008年9月25日21时10分,在中国酒泉卫星发射中心,发射神舟七号飞船的长征二号F型运裁火箭点火成功,全国上下一片欢腾。运载火箭使用偏二申肼(C2H8N2)作高能燃料,
N2O4与其反应放出的巨太能量作为航天运载火箭的推动力,从而颠利把飞船送入太空。反
应的化学方程式为:
 。回答:
。回答:
1.该反应中N2O4的作用是( )
A.作为氧化剂
B.作为还原剂
C.作为氧化剂和还原剂
D.既不是氧化剂又不是还原荆
27.(10分)一种氮肥由硝铵和硫铵混合而成,2.92 g此氮肥与足量烧碱反应放出0.896 L NH3(标准状况)。求:
(1)混合物中硝铵和硫铵的各自的物质的量。
26.(12分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:
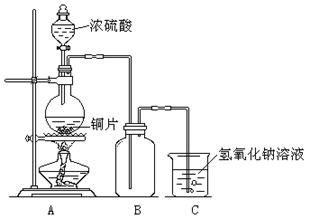
请回答下列问题:
(1)实验中他们取6.4 g铜片和12 mL 18 mol/L浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是 (填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
②实验中若有m g铜参加了反应,则有 mol H2SO4被还原。
③实验中氢氧化钠溶液的作用是 。
(2)为了测定剩余硫酸的物质的量浓度,该兴趣小组设计了三种实验方案:
方案1:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫的质量。
方案2:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
方案3:当铜和浓硫酸的反应结束后,在装置A中加入足量的锌粉,用排水法测得产生氢气的体积为V L(已换算为标准状况)。
实际上,以上方案1、2均不可取,请你说出原因?
方案1: 。
方案2: 。
方案3:写出剩余硫酸的物质的量浓度的计算式(假设反应后溶液的体积仍为12 mL)________________________________________________________。
25.(8分)为除去粗盐中的Ca2+、Mg2+、SO2-4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,其实验步骤如下(用于沉淀的试剂稍过量):


请回答下列问题:
(1)第②步中,加入稍过量的BaCl2溶液,目的是除去 。
(2)第④步中,有关反应的离子方程式是 。
(3)若先加盐酸再过滤,将影响实验结果,其原因是 。
(4)除题中设计的除杂操作步骤外,请你再写出一种合理的操作步骤(用序号表示)
|
24.(5分)汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:2NO2+4CO=N2+4CO2。
(1)用单线桥标出上述反应电子转移的方向和数目: 。
(2)该反应中氧化剂是 ,氧化产物是 ,每有28 g N2生成,反应中转移的电子为 mol。
23.(6分)49 g H2SO4的物质的量为 mol,所含O原子的个数为 ,若将这49 g H2SO4配制成500 mL溶液,其物质的量浓度为 mol/L。
22.(5分)漂白粉的有效成分为_____________(填化学式),漂白粉在空气中久置容易变质、失效,有关反应的化学方程式为_____________________________________
_______________________________________________________________________。
21.(4分)铁制品在电镀前可以用盐酸清除表面的铁锈(铁锈的主要成分是Fe2O3),此反应的离子方程式为__________________________________。若此反应生成物的溶液与除锈后的铁接触,其反应的离子方程式为________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com