
题目列表(包括答案和解析)
4、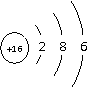

 根据下列原子结构示意图回答(用编号回答):
根据下列原子结构示意图回答(用编号回答):
 ①
②
③
④
①
②
③
④
⑴半径最小的是________ ⑵具有最低负化合价的是___________
⑶只有还原性的是______ ⑷只有氧化性的是_______
3、下列各组元素中按微粒半径递增顺序排列的是
A、Li Na K B、Ba2+ Ca2+ Mg2+ C、Ca2+ K+ Cl- D、N O F
2、下列元素原子半径最大的是
A、Li B、F C、Na D、Cl
1、元素周期律的内容和实质是什么?
2、离子半径大小的比较
(1)具有相同电子层结构的离子半径大小的比较
电子层数相同,随着核电荷数的增加,原子核对核外电子的吸引能力 ,半径 。
(2)同主族离子半径大小的比较
元素周期表中从上到下,电子层数逐渐 ,离子半径逐渐 。
(3)同一元素的不同离子的半径大小比较
同种元素的各种微粒,核外电子数越多,半径 ,高价阳离子半径 低价离子半径。
方法引导:在教材p11页画出以原子序数为横坐标、元素的主要化合价为纵坐标的折线图。对于元素主要化合价的变化,你的结论是什么?
交流研讨:展示其折线图,交流观点。
总结:随着原子序数的递增,元素的化合价呈现周期性变化。
且有以下量的关系:
│最高正价│+│负价│=_______
引导探究:综合以上的事实,各自发表自己的观点。大家可以得出什么结论?
总结:元素周期律:元素的性质随着元素原子序数的递增,而呈现出------ 的变化。

探究:元素的性质是由元素原子的哪一部分决定的?那么元素性质随原子序数的递增呈现出周期性变化的根本原因是什么?
总结:元素性质的周期性变化是--------------------------呈现周期性变化的必然结果
|
|
|

小结:

 以1-18号元素核外 分析归纳
最外层电子数随原子序数
以1-18号元素核外 分析归纳
最外层电子数随原子序数
 电子排布为例
递增呈周期性变化
电子排布为例
递增呈周期性变化

 决定
①元素原子半径的周期性变化 总结归纳
元素周期律
决定
①元素原子半径的周期性变化 总结归纳
元素周期律

 ②元素主要化合价的周期性变化
元素周期律实质
②元素主要化合价的周期性变化
元素周期律实质
达标检测:
交流与研讨:(1)填写教材P11页表中所缺的内容;
(2)对表中各项内容进行比较、分析,寻找其中的规律。
填表:填写p11的表格
方法引导:为了更直观地观察原子的最外层电子排布随原子序数变化而变化的具体情况,在教材p12页画出以原子序数为横坐标、原子的最外层电子数为纵坐标的直方图。
交流研讨:展示直方图。
引导:观察1-18号元素的最外层电子数的变化,我们发现从3号到10号,最外层电子由1增加到8,从11号到18号最外层电子数又由1增加到8。象这样每隔一定数量,又重现前面出现过的情况的变化称为周期性变化。
联想与质疑:通过直方图,对于原子的最外层电子数随原子序数的变化情况,你能得出什么结论?
总结:
方法引导:为了更直观地观察原子半径随原子序数变化而变化的情况,在教材p12页画出以原子序数为横坐标、原子半径为纵坐标的折线图。对于原子半径的变化,你的结论是什么?
交流研讨:展示其折线图,交流观点。
总结:
讲述:稀有气体元素的原子半径教材中没有列出,它跟邻近的非金属元素的原子相比显得特别大,这是由于测定稀有气体元素的原子半径的根据与其它元素的原子半径不同。
讨论:影响原子半径的因素:
(1)电子层数相同时,影响原子半径的因素是什么?
(2)最外层电子数相同时,其影响因素是什么?
总结:影响原子半径的因素:
电子层数相同,质子数越多,吸引力______,半径_________;
最外层电子数相同,电子层数越多,电子数越多,半径_________。
1、原子半径大小的比较
同主族,从上到下,原子半径逐渐 。
同周期,从左到右,原子半径逐渐 。
24.已知下列两个热化学方程式
2H2(气) + O2(气) === 2H2O(液) + 571.6kJ
‚C2H8(气) + 5O2(气) === 3CO2(气) + 4H2O(液) + 2220kJ
实验测得H2与C3H8的混合气体共5mol完全燃烧时放热3847kJ,则混合气体中H2与C3H8的体积比是
23.埋在地下的钢铁管道容易腐蚀而损坏,其原因在哪里?应采取何种措施保护埋在地下的管道?
22.(15分)某温度时,在3L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
(1)该反应的化学方程式: ;
(2)反应开始至2min末,X的反应速率为 ;
(3)该反应是由 开始反应的。(正反应‚逆反应ƒ正逆反应同时。)

21.(12分) 化学反应都伴随着能量的变化,通常表现为 的变化。化学反应在反应过程中放出或吸收的热都属于 。吸收热量的反应叫 ‚ 反应, 放出热量的反应叫 ƒ 反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com