
题目列表(包括答案和解析)
2、元素的相对原子质量(平均相对原子质量)的计算公式是:
_____________________________________________________________
例题2、设某种元素的原子核内质子数为m,中子数为n,则下列判断正确的是
A 不能由此确定该元素的相对原子质量。 B 若碳原子的质量为W克,则此原
子的相对原子质量为:(m+n)W。 C 该原子核的中子数总质量等于质子总质量。
D 该元素的相对原子质量为m+n。
例3、 氯元素存在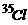 和
和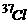 两种同位素,其相对原子质量为35.5,求11.7g氯化钠晶体中含
两种同位素,其相对原子质量为35.5,求11.7g氯化钠晶体中含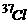 的质量为多少克?
的质量为多少克?
1、同位素:具有相同的质子数和不同中子数的同一元素的不同原子互称同位素。
同位素的特征:A、化学性质几乎完全相同,形成的物质的物理性质不同。
B、天然存在的各种同位素所占的________(丰度)一般不变。
(1)氢元素的同位素:
|
氢的同位素 |
氕 |
氘 |
氚 |
|
原子组成符号 |
|
|
|
|
代号 |
|
|
|
|
名称 |
|
|
|
|
形成水的化学式 |
|
|
|
|
水分子的式量 |
|
|
|
|
能形成________种氢分子,其分子量有___________种,_____________是制造氢弹的原料 |
例题:1、由某元素X构成的气态双原子分子有三中分子量,分别为70、72、74,该气体中三种分子的物质的量之比为9:6:1,试确定:
(1)X元素有____种同位数,其质量数分别为_________________;(2)各同位素的原子百分比分别是__________________。(3)X元素的相对原子质量为________________。
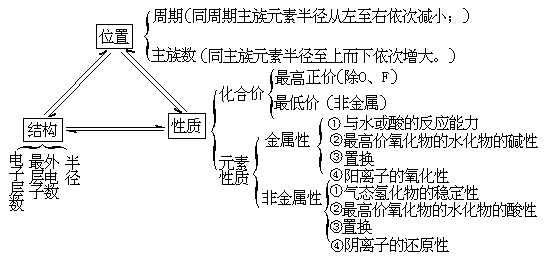
(二)元素性质的递变规律:
1、同一周期的主族元素的递变规律:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
1 |
第三周期 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
 2 2 |
原子半 径变化 |
|
||||||
 3 3 |
元素性 质递变 |
|
||||||
|
4 |
主要化 合价 |
|
|
|
|
|
|
|
|
5 |
最高价氧化物通式 |
|
|
|
|
|
|
|
|
6 |
最高价氧化物的水化物通式 |
|
|
|
|
|
|
|
 7 7 |
上述水化物的性质递变规律 |
|
||||||
|
8 |
气态氢化物的通式 |
|
|
|
|
|
|
|
 9 9 |
上述氢化物的稳定性递变 |
|
||||||
|
10 |
对应离子的符号 |
|
|
|
|
|
|
|
  11 11 |
离子的性质变化 |
|
|
|
|
2、同一主族元素的性质递变规律:
|
周期 |
原子 半径 |
金属性 |
最高价氧化物水化物 |
离子 半径 |
阳离子氧化性 |
阴离子还原性 |
氢化物 稳定性 |
最高价氧化物水化物 |
非金 属性 |
原子 半径 |
          1 1 |
|
|
|
|
|
|
|
|
|
|
|
2 |
||||||||||
|
3 |
||||||||||
|
4 |
||||||||||
|
5 |
||||||||||
|
6 |
||||||||||
|
7 |
3、元素周期表中“位”“构”“性”相互关系:
练习题:1、X、Y、Z为同周期元素,已知最高价氧化物的水化物的酸性强弱是HXO4>H2YO4>H3ZO4,则下列判断不正确的是
A 原子半径X>Y>Z B 非金属性X>Y>Z C 气态氢化物的稳定性X>Y>Z
D 阴离子的还原性X>Y>Z
2、短周期元素X和Y能形成XY4化合物,若X的原子序数为m,Y的原子序数为n,则m和n的关系不可能是
A m-13=n B m+5=n C m+8=n D m-11=n
4、若某元素其原子序数是88号元素,下列关于此元素的性质的描述不正确的是
A 其最高价氧化物的水化物加热分解 B 单质与水反应放出氢气
C 氢氧化物呈两性 D 碳酸盐难溶于水

(一)元素周期表的结构:
1、周期:
|
周期数 |
一 |
二 |
三 |
四 |
五 |
六 |
七 |
|
周期名称 |
|
|
|
||||
|
所含元素数目 |
|
|
|
|
|
|
|
|
起止原子序数 |
|
|
|
|
|
|
|
|
稀有气体 |
|
|
|
|
|
|
|
2、族:
|
族 |
主族 |
副族 |
第VIII族 |
O族 |
|
族中存在的数目 |
|
|
|
|
|
代号 |
|
|
|
|
|
最外层电子数 |
|
|
|
|
|
次外层电子数 |
|
|
|
|
|
在周期表中排列 |
|
2、共价键的极性与分子的极性的关系:
|
原子数目 |
分子 组成 |
举例 |
中心原子有无孤对电子 |
空间构型 |
所含键的极性 |
分子的极 性 |
|
双原子 分 子 |
A2型 |
X2 O2 H2 N2 |
|
|
|
|
|
AB型 |
HX CO NO |
|
|
|
|
|
|
三原子 分 子 |
AB2或A2B型 |
CO2 CS2
BeCl2 |
|
|
|
|
|
H2O H2S
SO2 |
|
|
|
|
||
|
四原子 分 子 |
AB3型 |
BF3 SO3 |
|
|
|
|
|
NH3 PH3 PCl3 |
|
|
|
|
||
|
五原子分子 |
AB4型 |
CH4 CCl4
SiCl4 |
|
|
|
|
1、规律:孤对电子的数目=最高正价(最外层电子数)-中心原子的化合价
|
共价键的物理量 |
键长 |
键能 |
键角 |
|
概念 |
|
|
|
|
表示的意义 |
|
|
|
|
判断依据 |
|
|
|
|
举例 |
H-F、H-Cl、 H-Br、H-I. |
H-F、H-Cl、 H-Br、H-I. |
H2O_____CO2______ NH3____BF3________ CH4______ |
2、共价键:
|
主族 |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
原子的电子式 |
C |
N |
O |
F |
|
形成共价键的数目 |
|
|
|
|
|
主要化合价 |
|
|
|
|
|
代表物质的电子式 |
CH4__________ CO2__________ SiCl4_________ |
N2__________ NH3_________ PCl3___________ |
H2O____________ CS2____________ H2O2___________ |
F2____________ HF___________ SiF4__________ |
|
对应物质的结构式 |
CH4__________ CO2__________ SiCl4_________ |
N2__________ NH3_________ PCl3___________ |
H2O____________ CS2____________ H2O2___________ |
F2____________ HF___________ SiF4__________ |
|
用电子式表示分子的形成过程 |
H2S_____________________________CO2_________________________________ SiH4_____________________________N2__________________________________ |
|||
|
规律 |
1、化合价的数目=最外层成键电子的数目=共价键的数目 2、原子间形成共价键后,每个原子周围达到稳定结构。 |
1、离子键:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
O |
|
原子的电子式 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
|
离子的电子式 |
|
|
|
|
|
|
|
|
|
离子化合物的电子式 |
氯化钠___________氯化镁______________硫化镁____________硫化钠__________ 氢氧化钠____________过氧化钠________________氯化铵________________ 氢氧化钡_________________________ |
|||||||
|
用电子式表示离子化合物的形成过程 |
氟化钙_____________________________氧化铷______________________________ 碘化钾_____________________________铵离子______________________________ |
|
化学键类型 |
离 子 键 |
共价键 |
||
|
非极性键 |
极性键 |
配位键 |
||
|
成键微粒 |
离 子 |
原 子 |
||
|
相互作用力 |
静电作用力 |
共用电子对 |
||
|
形成条件 |
得失电子 |
两个原子各提供未成对电配对成键 |
原子单方面提供孤对电子成键 |
|
|
形成元素 范 围 |
IA(除H)IIA(金属) VIA、VIIA(非金属) |
同种元素的原子间(不偏移) |
不同种元素的原子间(发生偏移) |
一原子有孤对电子,另一原子缺电子。 |
|
存在 |
离子化合物 |
单质分子(除稀有气体) |
共价化合物、复杂离子内。 |
NH4Cl等铵盐 |
|
实例表示 |
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com