
题目列表(包括答案和解析)
2.学习离子反应需注意的问题:
(1)判断某个化学反应是不是离子反应,首先要看这个反应是不是在___________进行(当然熔融状态也在内),只有确定了是离子反应,才能写出其离子方程式。
(2)在离子方程式里,把易溶、易电离的物质写成______________,把难溶的或难电离的物质以及气体物质等,写成它们的_______________。
(3)配平离子方程式,不仅要配平各元素原子或离子的个数,还要配平离子方程式两边的______________。
(4)离子方程式表示所有___________________的离子反应。
1.一般书写离子方程式时可分四步:
①写--根据客观事实,写出正确的________________。
②拆--把易溶于水且易电离的物质写成_____________形式,把难溶于水的物质或难电离的物质以及气体、单质、氧化物仍用___________表示。
③删--对方程式两边都有的相同离子,把其中不参加反应的离子,应“按数”消掉。
④查--检查写出的离子方程式是否符合前三项规定,并检查是否既符合质量守恒又符合电荷守恒,即方程式两边各元素的原子个数是否相等,方程式两边各离子所带电荷总数是否相等。
注:要想正确书写离子方程式,需掌握住难溶、微溶以及难电离的物质。
3.书写以下物质的电离方程式:
H2SO4____________________ HClO__________________
Ba(OH)2_________________ NaHCO3___________________.
新课预习
2.强弱电解质的本质区别_______________________________。
1.电离的含义__________________________________________________。
(二)离子的检验(试剂、方法、现象、离子方程式)
①Cl-的检验
②CO32-的检验
③SO42-的检验
[达标练习]
1、判断下列说法是否正确:
(1)食盐水能导电,是因为接通电源后,在直流电作用下,NaCl电离出了自由移动的
Na+、Cl-而导电。
(2)NaHSO4能电离出H+,故NaHSO4为酸。
(3)把CaCO3加入水中,不能导电,故CaCO3为非电解质或弱电解质。
(4)Fe能导电,故Fe为电解质,S不导电,故S为非电解质。
2、下列物质中能导电的是( ),属于电解质的是( ),
属于非电解质的是( )。
①汞, ②液氨, ③氯水, ④氯化钠晶体, ⑤盐酸, ⑥干冰, ⑦液氯, ⑧金刚石
3、下列离子方程式中正确的是( )
A、铁跟稀硫酸反应:2Fe+H+=2Fe3++3H2↑
B、碳酸氢钙溶液与稀盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
C、醋酸与氢氧化钾溶液:CH3COOH+OH-=CH3COO-+H2O
D、碳酸镁跟硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑
4、在下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓来表示的是( )
A、Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 B、BaCl2+Na2SO4=BaSO4↓+2NaCl
C、BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ D、BaCl2+H2SO4=BaSO4↓+2HCl
5、下列离子方程式中,正确的是( )。
A、稀硫酸滴在铜片上:Cu+2H+=Cu2++H2↑
B、硫酸钠溶液与氯化钡溶液混合: Ba2++SO42-=BaSO4↓
C、盐酸滴在石灰石上:CaCO3+2H+=Ca2++H2CO3
D、氧化铜与硫酸混合:Cu2++SO42-=CuSO4
6、下列各组中的离子,能在溶液中大量共存的是( )。
A、K+、H+、SO42-、OH- B、Na+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32- D、Na+、 Cu2+、Cl-、SO42-
7、某反应的离子方程式是S2-+2H+=H2S↑,此反应可能是
A、FeS+2HCl→ B、K2S+H2SO4(稀)→ C、CuS+2HCl→
8、写出与下列离子方程式相对应的化学方程式。
(1)Cu2++2OH-=Cu(OH)2↓
(2)H++OH-=H2O
(3)2H++CaCO3=Ca2++H2O+CO2↑
(4)2H++CO32-=H2O+CO2↑
9、如下图所示,在一烧杯中盛有100mL2mol·L-1的H2SO4溶液,同时有一表面光滑的塑
料小球悬浮于溶液中央。向该烧杯里缓缓注入0.4mol·L-1的Ba(OH)2溶液至恰好完全反应,
在此过程中:
 (1)烧杯里观察到的实验现象有:
(1)烧杯里观察到的实验现象有:
① _______________________________________
② _______________________________________
(2)写出实验过程中反应的离子方程式:______________

(一)离子共存问题(即判断离子间是否发生反应,能反应不能大量共存,反之能共存)
除熟悉前面提到的三个离子反应的条件外,特别注意下边四种情况:
①弱酸的酸根离子与H+不能大量共存:(请举三个例子)
②弱碱的阳离子与OH-不能大量共存:(请举两个例子)
③弱酸的酸式根离子与H+ 、OH-都不能大量共存:(请举三个例子)
④无色溶液中,有颜色的离子不能大量共存: (请举四个例子)
[练习]:在无色溶液中下列各组中的离子,能大量共存的是( )。
A、K+、H+、SO42-、Cl- B、Na+、Ca2+、CO32-、NO3-
C、Na+、H+、Cl-、CO32- D、Na+、 Cu2+、Cl-、 SO42-
E、Na+、HCO3-、OH-、SO42- F、PH=1的溶液中Na+、HCO3-
1、电解质在水溶液中反应的实质
[实验·探讨]
实验:向Ba(OH)2溶液中滴加几滴酚酞,测其导电性,然后逐滴加入稀H2SO4,观察溶液
中的现象和导电情况(看电流表指针的变化)。
现象:① ②
③ 。
分析原因:(1)写出H2SO4和Ba(OH)2的电离方程式
(2)说明出现上述现象的原因:
结论:该反应的实质为
练习:分析下列化学反应的实质:
①盐酸与氢氧化钠溶液的反应
②氯化钠与硝酸银溶液的反应
③碳酸钠与稀盐酸的反应
2、离子反应
概念: 条件:① ② ③
3、离子方程式的书写
(1)概念:
(2)离子方程式的书写
有两种书写思路:一是从溶液中所含离子的角度分析如何发生反应;
二是根据化学方程式改写。
①从溶液中所含离子的角度分析:以Ba(OH)2与H2SO4混合为例,其书写步骤为: ⅰ、分析各反应物在水溶液里的存在形式:
Ba(OH)2溶于水后存在 、 离子,H2SO4溶于水后得 、 。

ⅱ、按离子反应发生的条件判断上述微粒是否结合:
故 与 结合为 沉淀, 与 结合为 (弱电解质)
iii、综合i、ii写出离子方程式,对前后未变化的离子不写,只写实际参加反
应的离子。
Ⅳ、检查是否配平

离子方程式为:
②根据化学方程式改写:以Na2CO3与盐酸反应为例
i、写先正确写出化学方程式(必须配平):
ii、拆易溶的强电解质写离子符号,难溶物及弱电解质,气体,单质,氧化物仍
写化学式,上述反应改写为:
iii、删把前后未发生变化的离子删去,只剩下变化的离子,即用实际参加反应的
离子的符号表示出该反应的离子方程式。
离子方程式
Ⅳ、查检查是否配平:既注意质量守恒(微粒的种类和数量的守恒),又要注意电
荷守恒。
[练习]:书写下列反应的离子方程式:
(1)NaOH与H2SO4反应
(2)Ba(OH)2与HNO3反应
(3)KOH与盐酸反应
(4)Cu(OH)2与盐酸反应
(5)BaCl2与H2SO4反应
(6)Ba(NO3)2与K2SO4反应
(3)离子方程式的意义 :
4、离子反应的应用 :
4、原子结构示意图(或离子结构示意图)
练习:写出下列原子或离子的结构示意图:
Li___________15号元素_____________S2-______________55号元素_____________
38号元素的离子________________
(1)电子层数(原子或阴离子)=阳离子的电子层数+1=周期数
主族元素最外层电子数=最高正价(除F、O)=主族数=8-|最低负价(非金属)|
(2)原子或离子半径的判断方法:
①根据核外电子层结构:
A 电子层数越多,半径______; B 电子层数相同时,核电荷数越在,半径_____。
②根据周期表中的位置:
A 同主族的原子或离子半径依次_____;B 同一周期的主族元素从左至右依次_____.
(3)写出下列主族元素的离子符号:(按半径从小到大排列)
核外2个电子的结构(He)的离子有_____________________________________;
核外10个电子的结构(Ne)的离子有_____________________________________;
核外18个电子的结构(Ar)的离子有_____________________________________;
例题6、已知两种主族元素的离子aXm+与bYn-核外均有18个电子,试确定:
(1)a 、m、b、n的相互关系__________(2)X和Y的离子的半径大小比较________________(3)比较X、Y的原子半径大小____________________(4)写出X的离子的图结构示意
_____________Y的原子结构示意图_______________________。
(4)试确定X、Y在周期表中的位置________________________________________________

3、构成原子的微粒间的关系:
(1)质量关系:质子数(Z)+中子数(N)=质量数(A)=该原子的近似相对原子质量
质子的质量=中子的质量=1836个电子的质量
(2)电荷的关系:质子数=核电荷数=原子序数=核外电子数(原子)=核外电子数+离子
的电荷数(适用____离子)=核外电子数-离子的电荷数(适用____离子例题4、核内中子数为N0的R2+离子,质量数为A,则mgR的氧化物中所含质子的物质
的量为
A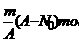 B
B C
C D
D
例5、1mol重水中含质子______个;1克重水中含电子_________个,10克重水含中子
________个;等质量的水和重水其物质的量之比为__________,质子数之比
__________个;中子数之比为_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com