
题目列表(包括答案和解析)
4、在一定温度下的恒容容器中,当下列物理量不再发生变化时,表明反应:
 A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是
A(固)+3B(气) 2C(气)+D(气)已达平衡状态的是
A.混合气体的压强 B.混合气体的密度 C.B的物质的量浓度 D.气体的总物质的量
3、 在一定温度下,可逆反应A(s)+2B(g) 3C(g)达到平衡的标志是
在一定温度下,可逆反应A(s)+2B(g) 3C(g)达到平衡的标志是
A.混合气体的密度不再变化 B.单位时间内生成1 molA,同时生成3 molC
C.A的浓度不再变化 D.A、B、C的分子个数比为1:3:2
2、 在一定温度下,可逆反应A(g)
+ 3B(g) 2C(g) 达到平衡的标志是
在一定温度下,可逆反应A(g)
+ 3B(g) 2C(g) 达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A,B,C的浓度不再变化
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C、的分子数之比为1 ∶3 ∶ 2
1、反应A + 3B = 2C + 2D在四种不同情况下的反应速率分别为:
①V(A)=0.15mol/(L·s) ②V(B)=0.6mol/(L.s)
③V(C)=0.4mol/(L·s) ④V(D)=0.45mol/(L.s)
该反应进行的快慢顺序为________________.
提示:以同一物质为标准,将其他物质表示的反应速率换算为用该物质表示的速率,并比较。
2、什么是化学平衡?它具有哪些特点?与溶解结晶平衡有什么相同的方面?
[练习]: [A组]
1、填写下表,总结影响化学反应速率的因素
|
条件 |
条件改变对化学反应速率的影响 |
|
浓度 |
|
|
压强 |
|
|
温度 |
|
|
催化剂 |
|
3、在容积不变密闭容器中,对于合成氨反应是否达到平衡的标志是
①V(N2)∶V(H2)= 1∶3 ②V(N2)∶V(NH3)= 1∶2
③ V(NH3)= 2 V(N2) ④V(NH3)分解= V(NH3)合成
⑤ C(NH3)= 2 C(N2) ⑥压强不变
⑦每消耗 n mol N2的同时生成 2n mol NH3
⑧密度不变
⑨混合气体中氮气的体积百分含量不变
[小结]判断化学反应达到平衡的标志:
两大特征:①v(正)=v(逆)②各组分浓度(或百分含量)保持不变
总之,若反应过程中变化的量保持不变,则反应达到平衡状态
|
反应 |
mA(g)+nB(g) ? pC(g)+qD(g) |
状态 |
|
体系中各成分的量 |
①各物质的量或量的分数(指n、m或v)一定 |
|
|
②总体积、总压力、总物质的量一定 |
|
|
|
v(正)与v(逆)的关系 |
①v(正)=v(逆) |
|
|
②各物质的速率之比等于化学计量数之比 |
|
|
|
压强 |
①若m+n≠p+q时,总压力一定 |
|
|
②m+n=p+q时,总压力一定 |
|
|
混合气体的平均分子量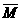 |
①当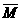 一定时,且m+n≠p+q时 一定时,且m+n≠p+q时 |
|
②当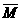 一定时,且m+n=p+q时 一定时,且m+n=p+q时 |
|
|
|
温度 |
体系的温度不变时 |
|
|
气体的密度 |
密度不变时 |
|
|
颜色 |
反应体系内有色物质的颜色稳定不变 |
|
|
化学键的断裂与化学键的形成 |
同种物质化学键的断裂与化学键的形成的 物质的量相等 |
|
[概括·整合]
2、 下列叙述中可以说明反应2HI H2 + I2(g)已达平衡状态的是
下列叙述中可以说明反应2HI H2 + I2(g)已达平衡状态的是
①单位时间内生成n mol H2的同时生成n mol HI
②一个 H-H 键断裂的同时有两个 H-I 键断裂
③百分组成 HI % = I2 % ④反应速率 V(H2) = V(I2 )= 1/2V(HI) 时
⑤[HI] ∶[H2]∶[I2] = 2∶1∶1 时 ⑥ V(HI)分解= V(HI)生成
⑦压强不变 ⑧ C(HI)= 2 C(I2)
1、下列有关化学平衡状态的描述正确的是
(1)化学平衡状态就是正逆反应速率相等,且均等于零,反应停止了的状态。
 (2)对于反应3Fe(S)+4H2O(g) Fe3O4(S)+4H2(g)
(2)对于反应3Fe(S)+4H2O(g) Fe3O4(S)+4H2(g)
①当压强不变时,反应达到平衡。
②当气体水的浓度不变时,反应达到平衡。
③当Fe3O4的质量不变时,反应达到平衡到达。
2、 压强对 2NO2(红棕色) N2O4(无色)反应平衡状态的影响:
压强对 2NO2(红棕色) N2O4(无色)反应平衡状态的影响:
①增大压强反应混合物的颜色先变深后变浅,但比原平衡混合物的颜色要深,平衡向生成N2O4的方向移动;
②减小压强反应混合物的颜色先变浅后变深,但比原平衡混合物的颜色要浅,平衡向生成NO2的方向移动。
如何解释上述颜色的变化?
(4)影响化学平衡移动的条件
①浓度:在其它条件不变时,增大反应物(或减小生成物)浓度,平衡向正反应方向移动。
②压强:在其它条件不变时,增大(或减小)压强,平衡向气体体积缩小(或扩大)的方向移动。
③温度:在其它条件不变时,升高(或降低)温度,平衡向吸热(或放热)方向移动。
[小结]:浓度、温度、压强对化学平衡的影响,都是向着减弱这种改变的方向移动;通俗的讲:平衡移动的方向与引起平衡移动的条件,总是“对着干”“反其道而行之”,且边移动边对抗,直到建立新的平衡,这种对抗才罢休。
[讨论]催化剂对化学平衡移动有影响吗?为什么?
 你如何认识硫酸工业的反应条件的选择?2SO2
+ O2 2SO3
你如何认识硫酸工业的反应条件的选择?2SO2
+ O2 2SO3
[思考讨论]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com