
题目列表(包括答案和解析)
2.在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g) N2O4(g) △H<0。把烧
N2O4(g) △H<0。把烧
瓶置于100℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均分子量 ③质量 ④压强 ⑤密度
A、①和③ B、②和④ C、④和⑤ D、③和⑤
1.用惰性电极进行电解,下列说法正确的是:
A、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
苏教版选修4《化学反应速率与化学平衡》单元检测试题
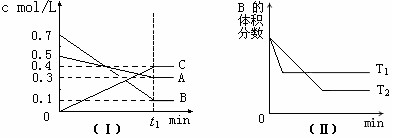
17、T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
A.在 t1时间内用B表示该反应的平均速率为0.6/ t1mol·L-1·min-1
B.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L-1 A、0.1 mol·L-1 B和
16.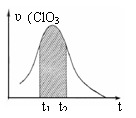 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+ Cl-+ H+(未配平)。已知该反应的速率随c(H+)的增大而加快。右图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图。下列说法正确的
A.反应开始时速率增大可能是c(H+)所致
B.纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合
C.后期速率υ下降的主要原因是反应向逆反应方向进行
D.图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量
15、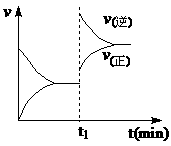 下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
下图为某化学反应速率-时间图。在t1时刻升高温度或增大压强,都符合下图所示变化的反应是
A.2SO2 (g)+O2 (g)  2SO3
(g) ;△H<0
2SO3
(g) ;△H<0
B.4NH3
(g)+O2 (g) 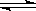 4NO(g)+6H2O
(g) ;△H<0
4NO(g)+6H2O
(g) ;△H<0
C.H2 (g)+I2 (g) 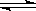 2HI
(g) ;△H>0
2HI
(g) ;△H>0
D.C (s)+H2O (g) 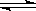 CO
(g)+H2
(g) ;△H>0
CO
(g)+H2
(g) ;△H>0
14、可逆反应A+B(s) C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
C达到平衡后,无论加压或降温。B的转化率都增大,则下列结论正确的是气体
A. A为固体C为气体,正反应为放热反应 B. A为气体C为固体,正反应为放热反应
C. A为气体C为固体,正反应为吸热反应 D. A、C均为气体,正反应为吸热反应
13、如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。

其它条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):2X(?)+Y(?) aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
aZ(g)。此时Ⅰ中X、Y、Z的物质的量之比为1:3:2,则下列说法一定正确的是
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
C.若X为固态,Y为气态,则Ⅰ、Ⅱ中从起始到平衡所需时间相同
D.平衡时Ⅰ容器的体积小于V L
12、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
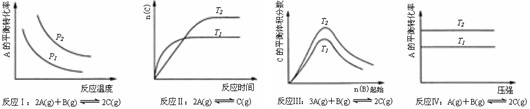
根据以上规律判断,上列结论正确的是
A 反应Ⅰ:△H>0,P2>P1 B 反应Ⅱ:△H<0,T1>T2
C 反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D 反应Ⅳ:△H<0,T2>T1
11、在容积固定的密闭容器中存在如下反应: A(g) + B(g)  3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
3 C(g); (正反应为放热反应)某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
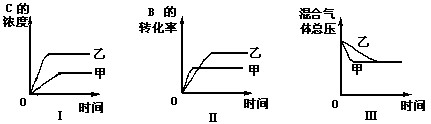
下列判断一定错误的是
A、图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C、图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D、图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com