
题目列表(包括答案和解析)
6. 植物及其废弃物可制成乙醇燃料,下列关于乙醇燃料的说法错误的是
A.它是一种再生能源 B.乙醇易燃烧,污染小
C.乙醇只能在实验室内作燃料 D.粮食作物是制乙醇的重要原料
5. 分子式为C4H10O并能与金属钠反应放出氢气的有机化合物有:
A.3种 B.4种 C.5种 D.6种
4. 下列有机反应中,不属于取代反应的是:
A.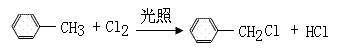
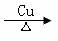
B.2CH3CH2OH+O2 2CH3CHO +2H2O
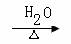
C.ClCH2CH=CH2+NaOH HOCH2CH=CH2+NaCl
D.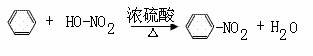
3. 下列关于热化学反应的描述中正确的是
A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的
ΔH=+(2×283.0)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热
2.下列叙述正确的是
A.汽油、柴油和植物油都是碳氢化合物
B.乙醇可以被氧化为乙酸,二者都能发生酯化反应
C.甲烷、乙烯和苯在工业上都可通过石油分馏得到
D.含5个碳原子的有机物,每个分子中最多可形成4个C-C单键
1.不能被人体消化吸收的高分子化合物是
A.油脂 B.淀粉 C.纤维素 D.蛋白质
23、(10分)合成氨反应:N2(g) +3H2(g)  2NH3(g) ;ΔH=-92.4kJ·mol-1。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。
2NH3(g) ;ΔH=-92.4kJ·mol-1。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400-500℃,压强-30-50MPa。
回答下列问题:
⑴ 合成氨工业中原料气压缩到30-50MPa的原因是 。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400-500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是 。
⑵ 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,
此时N2的转化率为x。则K和x的关系满足K= 。
⑶ 甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数据如下表:
|
物 质 |
燃烧热(kJ·mol-1) |
|
H2(g) |
-285.8 |
|
CO(g) |
-283.0 |
|
CH4(g) |
-890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式 。
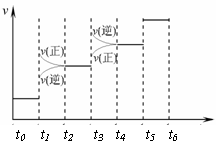 (2) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
。
(2) 当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示。图中tl 时引起平衡移动的条件可能是
。
其中表示平衡混合物中NH3的含量最高的一段时间是 。
22. (12分)已知:CH3COONa
+ NaOH
CH4↑+ Na2CO3
(12分)已知:CH3COONa
+ NaOH
CH4↑+ Na2CO3
现有化合物A、B均是分子式为C8H8O3的无色液体.从A、B开始,可发生图示的一系列反应(反应中的无机物已全部略去),E的苯环上的一取代物只有两种.
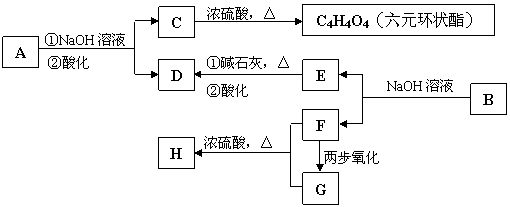
(1)A的结构简式为 .
(2)H和G中含有相同的官能团,该官能团的名称 .
(3)写出C → C4H4O4 反应的化学方程式
(4)F与G反应生成H的化学方程式
(5)化学式仍为C8H8O3,能发生银镜反应,且苯环上的一取代物仅有一种的所有同分异构体的结构简式:
21.(7分)CuSO4溶液对过氧化氢的分解具有催化作用,有同学猜想其他盐溶液也能在这个反应中起同样的作用,于是他们做了以下的探究。 (1)请你帮助他们完成实验报告: 实验过程:在一支试管中加入5ml5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。 实验现象:① 实验结论:FeCl3溶液可以催化分解H2O2 (2)已知FeCl3在水中可解离出Fe3+ 和Cl-,同学们提出以下猜想: 甲同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的H2O; 乙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Fe3+; 丙同学的猜想是;真正催化分解H2O2的是FeCl3溶液中的Cl-;
你认为最不可能的是 ② 同学的猜想, 理由是 ③ 。 (3)同学们对余下的两个猜想,用实验进行了探究.请你仔细分析后填表: 实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的HCl,并把带火星的木条伸入试管。 实验现象:无明显现象 结论④ 。 实验过程:向盛有5ml5%的H2O2溶液的试管中加入少量的⑤ ,并把带火星的木条伸入试管. 实验现象:⑥ 。 结论:⑦ 。
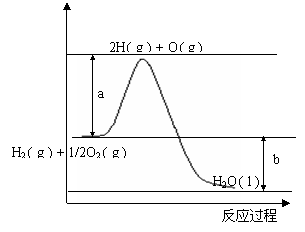
20.(9分)已知H2的燃烧热为285.8kJ·mol-1,反应过程中能量变化如下图:

 请回答下列问题:
请回答下列问题:
(1)图中a,b分别代表什么意义?
a. ;b. 。
(2)该反应的△H (填“< 0”或“> 0”)。
(3)表示H2燃烧热的热化学方程式为____________________________________________,已知H2O(g)=H2O(l);△H=-44kJ·mol-1,标准状况下4.48LH2在1.00molO2中燃烧生成水蒸气时产生的热量为__________________kJ。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com