
题目列表(包括答案和解析)
4.在蒸发皿中加热蒸干下列物质的溶液,再灼烧(溶液低于400℃)可以得到原 溶质 固体的是
A. AlCl3 B. NaHCO3 C. MgSO4 D. KMnO4
3. 下列说法正确的是 :
A. 需要加热的化学反应都是吸热反应
B. 中和反应都是放热反应
C. 原电池是将电能转化成为化学能的装置
D.水利发电是将化学能转化成电能的过程
2. 在2A + B = 3C + 4D的反应中,下列表示该反应的化学反应速度最快的是( )
A、v (A) = 0.5 mol/(L·s) B、v (B) = 0.3 mol/(L·s)
C、v (C) = 0.8 mol/(L·s) D、v (D) = 1.0 mol/(L·s)
1. 下列物质的水溶液能导电,但属于非电解质的是( )
A.CH3COOH B.Cl2 C.NH4HCO3 D.SO2
21.(12分)在一定温度下,在一体积固定的密闭中加入2 mol X和1 mol Y,发生如下反应:

 2X(g)+Y(g) a Z(g)+W(g) △H=-Q kJ·mol-1(Q>O)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
2X(g)+Y(g) a Z(g)+W(g) △H=-Q kJ·mol-1(Q>O)(a是正整数)当反应达到平衡后,反应放出的热量为Q1kJ,物质X的转化率为α;平衡后再升高温度,混合气体的平均相对分子质量减小,则
(1)温度升高,平衡常数K的值_______________(填“增大”、“减小”或“不变”)。
(2)化学计量数a的值为______________。
(3)有同学认为,Q1一定小于Q,你认为该结论是否正确?___________________,其理由是____________________________________________________________。
(4)维持温度不变,若起始时向容器中加入的物质的量如下列各项,则反应达到平衡后放出的热量仍为Q1 kJ的是_____________(稀有气体不参与反应)。
A.2 molX、1mol Y、1molAr
B.a molZ、1mol W
C.1 molX、0.5mol Y、0.5a molZ、O.5 mol W
D.2 molX、1mol Y、lmolZ
(5)X的转化率α=_______________________(用含Q、Q1的代数式表示)。
20.(12分)
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
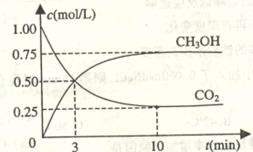
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:

 CO2(g)+3H2(g) CH30H(g)+H20(g)△H=-49.0kJ·mol-1测得C02和CH3OH(g)的浓度随时间变化如上图所示。
CO2(g)+3H2(g) CH30H(g)+H20(g)△H=-49.0kJ·mol-1测得C02和CH3OH(g)的浓度随时间变化如上图所示。
①从反应开始到平衡,以氢气表示的平均反应速率v(H2)=____________mol·L-1·min-1。
②下列措施中能使n(CH3OH)/n(C02)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的02,科研工作者通过某种电化学装置实现了上述目的。该电化学装置内的总反应为:2CO2=2CO+O2,阴极反应式为:2C02+4e-+2H20=2C0+40H-,则阳极反应为:___________________________。该反应产生的CO会对环境产生污染,有人提出,通过加强热使CO分解的方法来消除污染,请你判断是否可行?________,说出理由:____________________________________________。 (已知反应2C0=2C+O2的△H>O、△S<O)
19.(13分)
(1)实事证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是_________________。
A.C(s)+H20(g)=C0(g)十H2(g) △H>O
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H20(l) △H<O
C.2H2(g)+O2(g)=2H2O(l) △H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为:____________________________________________________________。
(3)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中,a为电解液,X和Y是两块电极板,则:
①若X和Y均为惰性电极,a为CuSO4溶液,则电解时的化学反应方程式为______________________________。通过一段时间后,向所得溶液中加入0.2molCu0粉末,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为__________________。
②若X、Y分别为铁和铜,a仍为CuSO4溶液,则Y极的电极反应式为_________________________________________。
18.(9分)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在相同的室温下对该产品的两个探究实验:
[实验1]向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mol氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mol氯化钠粉末;
③1.Omol镁粉、0.10mol铁粉、0.10mol氯化钠粉末;
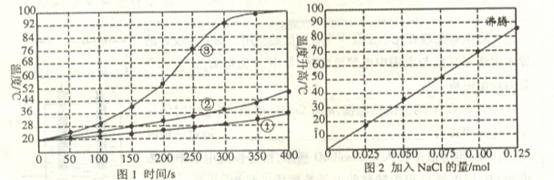
[实验2]向加有lOOmL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是_____________________。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是____________。
A.加入更多的NaCl不再增加反应速率
B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化
D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060molNaCl,则第15min时混合物升高的温度最接近于____________。
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是___________________________________。
17.(10分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________________________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
|
化学键 |
H-H |
N-H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |

 已知反应N2+3H2 NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为___________________。
已知反应N2+3H2 NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为___________________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-393.5kJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-571.6kJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:
△H=______________________________________。
16.如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是( )
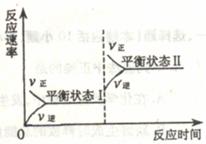 A.反应达平衡时,正反应速率和逆反应速率相等
A.反应达平衡时,正反应速率和逆反应速率相等

 B.若反应为A(g)+B(g) C(s),则平衡移动的原因是增大压强
B.若反应为A(g)+B(g) C(s),则平衡移动的原因是增大压强
C.由图像关系可以判断,正反应为吸热反应
D.平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1=K2
第Ⅱ卷(非选择题,共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com