
题目列表(包括答案和解析)
8.化学与社会、生活、环境保护密切相关,下列现象或事实与解释一致的是( )
|
编号 |
现象或事实 |
解释 |
|
A |
用热的纯碱溶液洗去油污 |
纯碱可以直接与油污反应 |
|
B |
在农田施肥时,草木灰(主要成分K2CO3)不能与氯化铵混合使用 |
一定条件下,K2CO3与NH4Cl会发生反应,有“跑氨”现象 |
|
C |
漂白粉因在空气中放置时间过久而变质 |
漂白粉中的CaCl2与空气中的CO2反应生成碳酸钙 |
|
D |
利用氯化铁溶液可以制作铜质印刷线路板 |
FeCl3溶液置换出铜单质 |
7.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的( ) A. 滴加酚酞试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- B. 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ C. 所含溶质为Na2SO4的溶液 K+、CO32-、NO3-、Al3+ D. pH=1的溶液 Cu2+、Na+、Mg2+、NO3-
6.能正确表示下列反应的离子方程式是( )
A.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
B.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
C.氨水中滴加盐酸:H+ + NH3·H2O = NH4+ + H2O
D.向Ba(OH)2溶液中加入H2SO4溶液: Ba2++ OH-+ H+ +SO42-= BaSO4↓+ H2O
5.下列情况下,反应速率相同的是 ( )
A.等质量锌粒和锌粉分别与等量1 mol/L HCl反应
B.等体积等浓度盐酸和醋酸分别与等质量的Na2CO3粉末反应
C.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与等体积0.2 mol/L NaOH液反应
D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等质量、等品质的石灰石反应
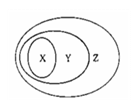
4.右图用交叉分类法表示了一些物质或概念之间的从属或包含关系,其中不正确的是( )
|
|
X |
Y |
Z |
|
例 |
氧化物 |
化合物 |
纯净物 |
|
A |
硫酸铜 |
盐 |
纯净物 |
|
B |
盐酸 |
电解质溶液 |
分散系 |
|
C |
碱性氧化物 |
氧化物 |
化合物 |
|
D |
置换反应 |
氧化还原反应 |
离子反应 |
3.下列操作中,能使电离平衡H2O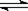 H++OH-,向右移动且溶液呈酸性的是( )
H++OH-,向右移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使pH=6
2. 下列事实不能用勒夏特列原理解释的是( )
A. 温度控制在500℃有利于合成氨反应
B. 用排饱和食盐水法收集Cl2
C. 打开碳酸饮料会有大量气泡冒出
D. 工业制取金属钾 Na(l)+KCl(l)  NaCl(l)+K(g)选取适宜的温度,使钾成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使钾成蒸气从反应混合物中分离出来
1.下列说法正确的是( )
A.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
B.物质发生化学变化时都伴随着能量变化
C.活化分子之间发生的碰撞一定为有效碰撞
D.对有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使反应速率增大
24.(10分)环境问题备受全世界关注。化工厂以及汽车尾气排放的一氧化碳(CO)、氮氧化物(NOx)等气体己成为大气污染的主要因素。汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”。
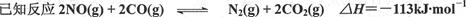
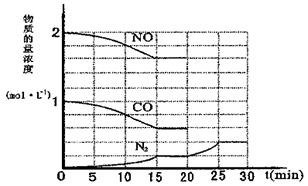 为了模拟催化转化器的工作原理,在t℃时,将2 molNO与1 mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如下图所示。
为了模拟催化转化器的工作原理,在t℃时,将2 molNO与1 mol CO充入lL反应容器中,反应过程中NO(g)、CO(g)、N2(g)物质的量浓度变化如下图所示。
(1) 当15 min达到平衡后,此时NO的转化率为__________。
(2)写出该反应的化学平衡常数表达式K= ,此条件下反应
的 K = (填计算结果,可用化简后的分数值表示);
如温度升高时,K值 (增大、减小、不变);
增大压强时,K值 (增大、减小、不变)。
(3)根据图中20 min-25 min内发生变化的曲线,分析引起该变化的条件可能
是 ;
A.加入催化剂 B.降低温度
C.缩小容器体积 D.增加CO2物质的量
(4)当15 min达到平衡后,若保持体系温度、体积不变,再向容器中充入2molNO、lmolCO,
平衡将 移动(填“向左、向右、不”)。
23.(10分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
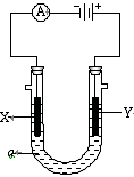 (1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中X极上的电极反应式为 ,
②Y电极上的电极反应式为 ,
在Y极附近观察到的现象是 。
③电解总反应方程式为 。
(2)如X是金属铁,要在铁件的表面镀铜防止铁被腐蚀,则
① Y电极的材料是 ,电极反应式是 。
电解液a选用 溶液。电解过程中其浓度 (增大、减小或不变)
② 若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者
质量差为5.12 g,则电镀时电路中通过的电子为__________mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com