
题目列表(包括答案和解析)
24.已知可逆反应:M(g)+N(g) P(g)+Q(g);△H>0,
P(g)+Q(g);△H>0,
请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)= 1 mol·L-1, c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时该反应的平衡常数为多少 ?(有计算过程)
(2)若反应温度降低,平衡常数将 (填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为:c(M)= 4 mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2 mol·L-1,a= 。(有计算过程)
[
24(10分).
⑴ (4′) 1/2
⑵(2′)减小
⑶ (4′) 6

23. 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) 。
22.(14分)
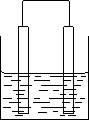
甲乙两池电极材料均为铁棒与碳棒,请回答下列问题:
I.若两池中均为CuSO4溶液
电 源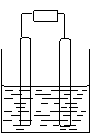 →e-
→e-

|
|
|
|


甲 乙
① 甲为___________池,乙为 ___________池;
②反应一段时间后,有红色物质析出的是甲池中的_____________棒,乙池中的__________棒;
③乙池中阳极上的电极反应式是____________________
II 若两池中均为饱和NaCl溶液:
① 写出乙池中总反应的化学方程式_____________________
② 甲池中碳棒上的 电极反应式是_________________;乙池中碳棒上的电极反应属于______________(填“氧化反应”或是“还原反应”)
③ 在乙池中的两极上各滴加几滴酚酞, __________棒附近出现红色。
④ 25℃若乙池转移0.02mol电子后停止实验,该池中溶液体积为200毫升,则溶液混匀后溶液的pH=__________
21.(8分)
⑴25℃时0.1mol·L-1NaOH溶液的pH___________;
⑵25℃时0.1mol·L-1NH4Cl溶液的pH____________7(填“>”、“<”或“=”),
其原因是_______________________________(用离子方程式来表示)
⑶将上述两溶液等体积混合,离子浓度大小顺序正确的是_____________(填序号)
A.c(Na+) >c(Cl-) >c(OH-) >c(H+)
B. c(Na+) >c(Cl-) >c(H+) >c(OH-)
C. c(Na+) =c(Cl-) >c(OH-) >c(H+)i
D.c(Cl-) > c(Na+)>c(OH-) >c(H+)
20. 已知反应A2(g)+2B2(g)= 2AB2(g) △H <0,下列说法正确的 ( )
A.升高温度,正向反应速率减小,逆向反应速率增大
B.升高温度有利于正、逆反应速率增大,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡逆向移动
D .达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
试卷II(共40分)
19.体积相同的甲、乙两容器中分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2 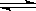 2SO3并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器内SO2的转化率为P%,则乙容器中SO2的转化率
2SO3并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器内SO2的转化率为P%,则乙容器中SO2的转化率
A、等于P% B、大于P% C、小于P% D、无法判断
18. 在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A.B.C均为气体)。若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是( )
A、3.6mol B、3.2mol C、2.8mol D、1.6mol
17.可逆反应aA(g) + bB(g) cC(g) + dD(g)符合下图。则下列叙述正确的是( )
cC(g) + dD(g)符合下图。则下列叙述正确的是( )


A.a+b < c+d;正反应吸热 B.a+b > c+d;正反应放热
C.a+b < c+d;正反应放热 D.a+b > c+d;正反应吸热
16.某原电池总反应离子方程式为.2Fe3++Fe=3Fe2+ ,不能实现该反应的原电池是( )
A.正极为Cu,负极为Fe,电解质溶液为FeCl3 溶液
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3 溶液
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 溶液
D.正极为Ag,负极为Fe,电解质溶液为CuSO4溶液
15.在水中加入等物质量的Ag+、Pb2+ 、Na+、 NO3- 、Cl-、SO42-,该溶液放在用惰性材料作电极的电解槽中通电片刻,则氧化产物与还原产物的质量之比为:
A.35.5:108 B. 16:207 C. 8:1 D. 108:35.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com