
题目列表(包括答案和解析)
19.(10分)
 (1)
(4分)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_______________;K值大小与温度的关系是:温度升高,K值________________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(1)
(4分)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_______________;K值大小与温度的关系是:温度升高,K值________________(填“一定增大”、“一定减小”、或“可能增大也可能减小”)。
(2)(5分)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应: CO(g)十H2O(g)
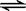 CO2(g)十H2
(g) △H<0
CO2(g)十H2
(g) △H<0
CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=_____________,该温度下平衡常数K的数值为_____ ____。
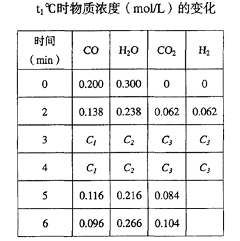 (3)
(8分)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
(3)
(8分)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表。
① 表中3min-4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
② 反应在4min-5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
18.(9分)在25℃时,对于0.1mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中将 (填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,此时溶液的pH 7(填“大于”、“小于”或“等于”),用离子方程式表示其原因 ,此时溶液中各离子浓度由大到小的顺序为 ;
(3)若向氨水中加入0.05mol·L-1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1 V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式 。
17.(6分)氢能是高效、清洁能源,制氢技术的研究开发是氢能利用的必由之路。燃料水蒸气重整法是一种有效、经济、广泛采用的制氢方法,它是通过水蒸气与燃料间的反应来制取氢气的。
(1)在催化剂作用下,天然气和水蒸气反应可制得一氧化碳和氢气,已知该反应每制得1kg氢气需要吸收3.44×104 kJ热量,请写出该反应的热化学方程式: ;
(2)CO可继续与水蒸气反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH= -41.0kJ·mol-1。若将1mol甲烷与足量水蒸气充分反应得到1molCO2,该反应的焓变ΔH= ;
(3)欲制得较纯净的氢气,可将(2)中充分反应后的气体通过足量的烧碱溶液,写出该反应的离子方程式 ;
16.常温下,将0.02 mol·L-1的Ba(OH)2溶液100mL和0.02 mol·L-1NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液
A.pH=12 B.溶质的物质的量浓度=0.02 mol·L-1
C.pH=2 D.由水电离的产生的c(H+)=1.0×10-2 mol·L-1
第II卷(非选择题 共52分)
15.一元强酸HA的水溶液在加适量碱MOH后,溶液呈中性,下列判断中一定正确的是
A.加入碱过量 B.反应后溶液中c(A-)=c(M+)
C.生成的盐不水解 D.酸与碱等物质的量混合
14.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
|
物质 |
X |
Y |
Z |
|
初始浓度/mol·L-1 |
0.1 |
0.2 |
0 |
|
平衡浓度/mol·L-1 |
0.05 |
0.05 |
0.1 |
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
13.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
 反应混合物的浓度 B.
反应体系的压强 C.正、逆反应的速率 D. 反应物的转化率
反应混合物的浓度 B.
反应体系的压强 C.正、逆反应的速率 D. 反应物的转化率
12.为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是
A.NaOH B.MgO C.氨水 D.铁粉
11.已知下列热化学方程式:
1/2CH4 (g) + O2(g) = 1/2CO2(g) + H2O(l);△H = -445.15kJ·mol-1
CH4 (g) + 3/2O2(g) = CO(g) + 2H2O(l);△H = -607.3 kJ·mol-1
CH4 (g) + 2O2(g) = CO2(g) + 2H2O(l);△H = -890.3 kJ·mol-1
CH4 (g) + 2O2(g) = CO2(g) + 2H2O(g);△H = -802.3 kJ·mol-1
则甲烷的燃烧热△H为
A.-445.15kJ·mol-1 B.-607.3 kJ·mol-1
C.-890.3 kJ·mol-1 D.-802.3 kJ·mol-1
10.下列反应中,属于水解反应且使溶液显酸性的是
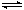
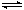 A.NH4+ + H2O NH3·H2O + H+ B.HCO3-+
H2O CO32- + H3O+
A.NH4+ + H2O NH3·H2O + H+ B.HCO3-+
H2O CO32- + H3O+
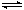
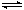 C.S2- + H2O HS-+ OH-
D.NH3
+H2O NH4+ +OH-
C.S2- + H2O HS-+ OH-
D.NH3
+H2O NH4+ +OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com