
题目列表(包括答案和解析)
14.(10分)在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示。请认真观察下图,然后回答问题。
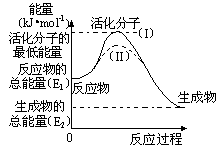 (1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的△H= (用含E1、E2的代数式表示)。
(1)图中反应是 (填“吸热”或“放热”)反应,该反应 (填“需要”或“不需要”)环境先提供能量,该反应的△H= (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g)
△H= -241.8kJ•mol-1,该反应的活化能为167.2 kJ•mol-1,则其逆反应的活化能为 。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能 ,单位体积内活化分子的百分数 ,因此反应速率 ,你认为最可能的原因是 。
13.(12分)把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
请回答下列问题:
(1) 途径I放出的热量 ( 填“大于”“等于”或“小于”) 途径II放出的热量,原因是
。
(2) △H1、△H2、△H3、△H4的数学关系式是 。
(3)12g 炭粉在氧气中不完全燃烧生成一氧化碳,放出110.35kJ热量。其热化学方程式为
。
(4)煤炭作为燃料采用途径II的优点有
。
12.(10分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是 (填字母)。
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(2)用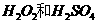 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
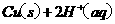 ====
====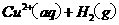
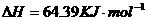
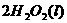 ====
====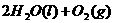
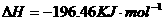
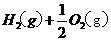 ====
==== 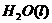
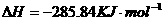
在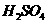 溶液中
溶液中 与
与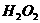 反应生成
反应生成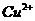 和
和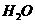 的热化学方程式为
的热化学方程式为
。
(3)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
11.(18分)2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的
ΔH= -99kJ·mol-1。请回答下列问题:
(1)图中A、C分别表示 、
,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式
、 。
(4)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H(要求计算过程)。
10. 如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是( )
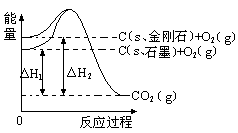
A. C(s、石墨)== C(s、金刚石) △H= +1.9 kJ•mol-1
B. 石墨和金刚石的转化是物理变化
C. 石墨的稳定性强于金刚石
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
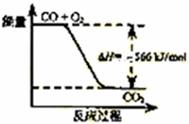
9.已知:2CO(g)+O2(g)=2CO2(g) ΔH= -566 kJ/mol
 Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+
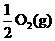 ΔH=
ΔH=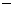 226
kJ/mol
226
kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为566 kJ/mol
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>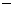 452 kJ/mol
452 kJ/mol
D.CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移数为1.204×1024(个)
8. 25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)=== CH3COONa(aq)+H2O(l)
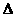 H=
H=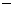 57.3kJ/mol
57.3kJ/mol
B.KOH(aq)+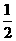 H
H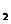 SO4(aq)=
SO4(aq)=
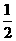 K2SO4(aq)+H2O(l)
K2SO4(aq)+H2O(l) 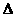 H=
H=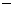 57.3kJ/mol
57.3kJ/mol
C.C8H18(l)+ 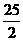 O2 (g)=8CO2 (g)+ 9H2O(g)
O2 (g)=8CO2 (g)+ 9H2O(g) 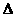 H=
H=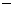 5518
kJ/mol
5518
kJ/mol
D.2C8H18(g)+25O2 (g)=16CO2
(g)+18H2O(1)
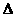 H=
H=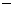 11036
kJ/mol
11036
kJ/mol
7.已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1 = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H3 = ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是( )
A.放出的热量为(0.4Q1+0.05Q3)KJ/mol
B.放出的热量为(0.4Q1+0.05Q2)KJ/mol
C.△H2 > △H3
D.△H2 <△H3
6.相同温度下,有下列三个热化学方程式:
(1)2H2(l)+O2(g)=== 2H2O(l) △H1= -Q1 kJ• mol-1
(2)2H2(g)+O2(g)=== 2H2O(l) △H1= -Q2 kJ• mol-1
(3)2H2(l)+O2(g)=== 2H2O(g) △H1= -Q3 kJ• mol-1
则Q1、Q2、Q3的关系表示正确的是( )
A. Q1=Q2<Q3 B. Q2 > Q1 >Q3
C. Q3> Q2> Q1 D. Q1=Q2=Q3
5. 在一定条件下A与B反应可生成C和D,其能量变化如图:
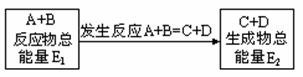
下列有关反应A+B===C+D的说法正确的是( )
A.反应前后原子的种类和数目一定不变
B.反应前后分子的种类和数目一定改变
C.反应物的总能量E1与生成物的总能量E2一定相等
D.此反应一定有热量的变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com