
题目列表(包括答案和解析)
21、 I (2分) 下列实验操作及实验结果处理正确的是 (填序号)。
A.用托盘天平称取5.5 g KCl固体
B.在酸碱中和滴定实验中,用20mL量筒量取20. 00 mL待测NaOH溶液
C.将pH试纸浸入某溶液一会儿后取出,与标准比色卡比较以测定该溶液pH
D.若用水润湿过的pH试纸去测pH相等的H2SO4和CH3COOH,则CH3COOH的误差更大
E.在制备Fe(OH)2时,为了能观察到产生的白色沉淀滴加NaOH的滴管应伸到FeSO4溶液液面以下
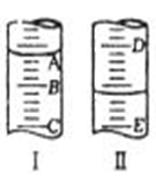
II(2分)(1)图I表示10mL量筒中液面的位置,A与B,B与C刻
度相差1mL,如果刻度A为6,量筒中液体的体积是___________mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_____________。
 A.是a
mL B.是(50-a)mL C.一定大于a D.一定大于(50-a)mL
A.是a
mL B.是(50-a)mL C.一定大于a D.一定大于(50-a)mL
第II卷(非选择题 共50分)
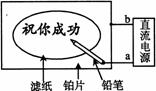
20. 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
A. 铅笔端作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端有少量的氯气产生
D. a点是负极,b点是正极
第I卷(选择题 答题栏)
19. 电解质溶液的酸度(用AG表示)定义为 C(H+)与C(OH-)比值的对数,即AG=lg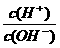 。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是( )
。常温下,下列各组离子在AG=12的无色溶液中能大量共存的是( )
A. Mg2+、Ca2+、HCO3-、Cl- B. K+、I-、SO42-、Br-
C. MnO4-、Ca2+、Cl-、NO3- D. Na+、S2-、Cl-、SO42-
18. 在恒容的各个密闭容器中,下列反应分别达到平衡后,有关说法正确的是( )
A. 2HI(g)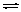 H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);△H>0,若降低温度,颜色加深,压强增大
B. 2NO2(g)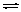 N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
N2O4(g);△H<0,充入氩气,压强增大,红棕色变浅
C. 2SO2(g)+O2(g)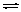 2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小
2SO3(g);△H<0,升温后,气体密度不变,平均相对分子质量减小
D. 3Fe(s)+4H2O(g)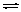 Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
Fe3O4(s)+4H2(g);△H<0,加入铁后,Fe3O4将增加
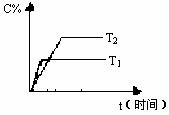
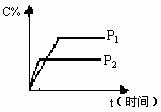
17. 可逆反应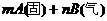
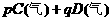 反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是( )
反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是( )
A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n > p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
16. 据报道,我国拥有完全自主产权的氢氧燃料电池车在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是( )
A. 正极反应式为:O2+2H2O+4e-=4OH-
B. 工作一段时间后,电解液中KOH的物质的量不变
C. 该燃料电池的总反应方程式为:2H2+O2=2H2O
D. 用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移
15. 实验室用铅蓄电池电解食盐水制取氯气。已知铅蓄电池放电时发生反应,负极: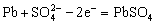 ,正极:
,正极: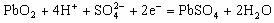 。当制得的氯气的物质的量为0.05mol时,电池内消耗硫酸的物质的量至少是( )
。当制得的氯气的物质的量为0.05mol时,电池内消耗硫酸的物质的量至少是( )
A. 0.025mol B. 0.050mol C. 0.10mol D. 0.20mol
14. 关于原电池和电解池的叙述正确的是( )
A. 原电池中失去电子的电极为阴极
B. 原电池的负极、电解池的阳极都发生氧化反应
C. 原电池的两极一定是由活动性不同的两种金属组成
D. 电解时电解池的阳极一定是阴离子放电
13. 下列说法正确的是( )
A. 在一定温度下AgCl水溶液中, 浓度的乘积是一个常数
浓度的乘积是一个常数
B. 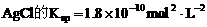 ,在任何含
,在任何含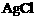 固体的溶液中,
固体的溶液中,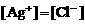 且它们浓度的乘积等于
且它们浓度的乘积等于
C. 温度一定时,当溶液中 浓度的乘积等于
浓度的乘积等于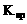 时,此溶液为AgCl饱和溶液
时,此溶液为AgCl饱和溶液
D. 向饱和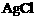 水溶液中加入盐酸,
水溶液中加入盐酸,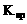 变大
变大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com